
Blodutstrykningsegenskaper, typer, tekniker och histologi

De Blodutstryk Det är ett perifert blodutstryk som används för att analysera de komponenter som finns i blodcirkulationen. Observationen av ett blodutstryk ger hematologiska data som är mycket användbara för diagnos och uppföljning av många patologier..
Blodutstrykningen gör det möjligt att kvantifiera antalet olika typer av vita blodkroppar (leukocytformel), samt möjliggör analys av morfologi och form av erytrocyter, leukocyter och blodplättar.

Det kan upptäcka abnormiteter i antalet celler, såsom: leukocytos eller leukopenier, lymfocytos eller lymfopeni, neutrofili eller neutropeni, trombocytos eller trombocytopenier och eosinofili. Avvikelser i cellform och storlek kan också ses..
Dessutom är det möjligt att upptäcka olika typer av anemier, leukemier och bakterie- eller blodparasitinfektioner..
För detta finns det olika typer av utstryk som utförs beroende på syftet med studien. Det finns tunna utstryk och tjocka utstryk. Dessa utstrykningar skiljer sig åt i exekveringstekniken och i syftet med studien..
De med fina droppar används som ett komplement till fullständig hematologi. Detta ger data om leukocytformeln, förutom analysen av formen och morfologin för de tre cellserier som utgör blodet: röda serier, vita serier och blodplättar. Även om de också fungerar som ett komplement till studien av tjock blodfilm.
Tjock blodfilm används för diagnos av sjukdomar orsakade av hemoparasiter, såsom malaria eller malaria, toxoplasmos, leishmaniasis, Chagas sjukdom, babesios och mikrofilariasis.
Artikelindex
- 1 Kännetecken för blodutstryk
- 2 Typer av blodutstryk
- 3 Tekniker för att ta blodprover
- 4 tekniker för beredning av blodutstryk
- 4.1-Glider utstryker
- 4.2 -Infrostning på täckglas
- 4.3 -Med automatiserad utrustning
- 5 Tjock utstrykningsteknik
- 6 Fläckar av utstryk
- 6.1 Giemsa-fläck
- 6.2 Wrights fläck
- 7 Typer av defekta utstryk
- 7.1 Smetar med områden med olika tjocklekar (tunna och tjocka varandra)
- 7.2 Smetar med mycket korta smet
- 7.3 Smörj med ett rakat område mot slutet av smetan
- 7.4 Smörjer ut med bildandet av vakuoler eller klara rundade eller elliptiska områden
- 7.5 Mycket tjocka eller mycket tunna utstryk
- 8 Histologi
- 8.1 -Erytrocyter eller röda blodkroppar
- 8.2 -Vita blodkroppar eller leukocyter
- 8.3 -Plattor
- 9 Patologiska element
- 9.1 Blodparasiter
- 9.2 Bakterier
- 9.3 Omogna celler
- 10 Referenser
Kännetecken för ett blodutstryk
Ett bra blodutstryk måste uppfylla vissa egenskaper. Bland dem kan vi nämna:
-Provet måste uppfylla minimikvalitetskraven för att vara representativt.
-Provtagningen måste utföras väl.
-Snabbt utförande av smetan.
-Om det utförs med venöst blod, använd ett antikoagulantia som inte deformerar cellerna och blanda röret innan du tar smetan..
-Kassera den första droppen om det görs med kapillärblod.
-Spridningen måste vara homogen. Detta säkerställer att cellerna fördelas jämnt och att en bra analys av blodkropparna, i form och antal, kan göras..
-Smutsens sidor ska vara släta från början till slut.
-Utstrykningen ska respektera en marginal på 1 till 2 mm mot sidans sidor.
-Smetskiktet bör gradvis minska i tjocklek från början till slut (tunn-dropputstrykning med glidmetoden).
-Måste märkas ordentligt för att undvika förvirring av provet.
-Fixera och fläck på lämpligt sätt för tydlig observation av blodelement.
-Låt smetan torka mycket bra innan du monterar preparatet under mikroskopet. Att placera olja i ett vått utstryk orsakar miceller som förhindrar att cellerna syns..
Typer av blodutstryk
Perifera blodutstryk kan klassificeras i tunt utstryk och tjockt utstryk. De med ett tunt skikt används för att studera leukocytformeln och morfologisk observation av blodceller. Du kan också se extracellulära bakterier som borrelia och intracellulära hemoparasiter, såsom plasmodium, bland andra..
I den fina klumpen kan parasitens art identifieras, därför är det en mer specifik teknik än den tjocka klumpen, men den tjocka klumpen är känsligare, eftersom det är en koncentrationsteknik som används för den uttömmande sökningen efter extracellulära hemoparasiter..
Det finns två typer av fina droppar: de som utförs på bilder och de som utförs på täckglas. De tjocka fläckarna utförs på bilderna.
Tekniker för att ta blodprover
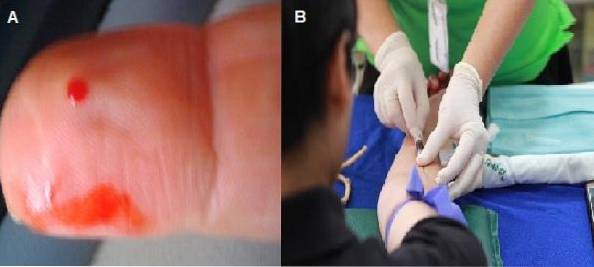
Blodutstryk kan göras från en kapillärpunktion eller ett venöst prov som tas med antikoagulantia. Om det görs från blod med antikoagulant, kan utstrykningen beredas upp till 2 timmar efter att provet tagits..
Försiktighet bör iakttas vid användning av antikoagulantia som inte deformerar blodkroppar. Det bästa alternativet är EDTA. Tvärtom bör användningen av antikoagulantia såsom trinatriumcitrat undvikas..
Om provet tas genom kapillär punktering, bör utstrykningen förlängas omedelbart innan blodet koagulerar.
Den första droppen bör kasseras så att nästa droppe kan fly spontant för att undvika utspädning av provet med vävnadsvätskan. Det är den mest rekommenderade tekniken för observation av cellmorfologi, eftersom blodet inte har några tillsatser.
För observation av hemoparasiter drog Solari et al. I sin forskning slutsatsen att båda teknikerna (venipunktur och kapillär) är lika effektiva..
Tekniker för beredning av blodutstryk
Blodutstrykningen kan utföras manuellt på objektglas eller på täckglas eller objektglas. Det är också möjligt genom automatiserad utrustning.
-Smeta på bilderna
Det är den teknik som de flesta laboratorier föredrar på grund av dess enkla hantering.
Använd en Pasteur-pipett och placera en inte så tjock eller mycket fin droppe blod i mitten av ena änden av ett rent mikroskopglas..
Smetan tillverkas med hjälp av en annan glid med markänd. Den slipade glasskivan är placerad vinkelrätt mot den motsatta änden av droppen..
Den lutar i en vinkel mellan 30 - 45 ° och glider mot droppen; Vid beröring expanderar den linjärt över kanten på marken och med en konstant och definierad rörelse återgår arket; innan du når änden lyfts rutschbanan.
På detta sätt sprids ett homogent skikt över mottagarglasets yta..
Smetan får torka. Den fixeras sedan och färgas med den föredragna fläcken. Låt torka väl innan du tittar i mikroskopet. En droppe olja placeras på ansiktet som presenterar smet och observeras under ett ljusmikroskop.
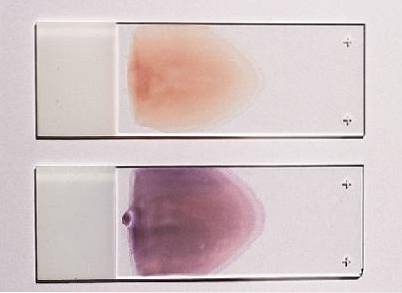
Delar av utstrykningen som görs på bilder
I denna typ av utstryk kan man skilja på tre definierade områden: huvudet, kroppen och svansen. Huvudet motsvarar det område där utsmetningen börjar, det är det tjockaste området och det är inte bra att observera.
Kroppen är den centrala eller mellanliggande delen av utstrykningen, det är det bästa området att observera under mikroskopet, för där är cellerna jämnt fördelade och deras morfologi bevaras.
Svansen motsvarar den sista delen av utstrykningen; här är fördelningen inte längre enhetlig och erytrocytmorfologin tenderar att gå vilse.
Kvalitetskontroll i bildtekniken
I denna teknik spelar den en grundläggande roll:
-Rengöring och avfettning av mikroskopglaset: säkerställer ett bra objektglas.
-Droppens storlek: med mycket stora droppar uppnås en tjockare och längre utstrykning, med en mycket liten droppe blir spridningen kortare och extremt fin.
-Hastigheten som tillämpas i förlängningen: ju lägre hastighet smet blir tunnare, desto högre blir hastigheten tjockare.
-Körningsvinkeln: ju mindre vinkel desto finare smet, desto högre vinkel desto tjockare.
-Smeta på täckglaset
Det används inte i stor utsträckning eftersom det är besvärligt att hantera de ömtåliga täckglasen, men det ger stora fördelar, eftersom en bättre fördelning av cellerna erhålls genom hela utstrykningen..
En inte så tjock eller mycket fin droppe placeras i mitten av ett täckglas. Omedelbart en annan täckglas placeras ovanpå den på ett sådant sätt att spetsarna på båda täckglasen sticker ut och bildar en stjärna.
Droppen sprids spontant över ytan på båda täckglasen. I slutet av förlängningen glider varje lamell till motsatt sida av varandra (en till höger och den andra till vänster) snabbt.
Tekniken ger två utstryk i stället för en.
De placeras för att torka med spridningssidan uppåt. När det är torrt fixeras det och färgas med den teknik du väljer. Låt det torka. En droppe nedsänkningsolja placeras på ett objektglas, utstrykningen placeras med utstrykningssidan nedåt och observeras under ett mikroskop..
Kvalitetskontroll i täckglastekniken
För att få ett bra utstryk för denna teknik är det viktigt att:
-Rengöring av täckglasen (hjälper till att provet glider bra).
-Droppens storlek (påverkar smetans tjocklek).
-Hastigheten med vilken täckglasen separeras (påverkar smetens homogenitet).
-Med automatiserad utrustning
De kan göras med någon av dessa utrustning: Spinner och Autoslide.
Spinner består av att placera ett objektglas med en droppe blod på en speciell centrifugplatta. Provet centrifugeras vid höga hastigheter; på detta sätt bildas en homogen och fin utstrykning av provet. Nackdelen med möjligheten till hemolys av provet.
Autoslide är ett instrument som mekaniskt utför rörelserna för utförandet av utstryket på bilderna. Du kan också fixa och fläcka utstrykningen. Det kan även anpassas till vissa automatiska hematologidiskar.
Tjock utstrykningsteknik
För att söka efter hemoparasiter rekommenderas att utföra två utstryk: en med en fin droppe och en med en tjock droppe..
Gör en kapillärpunktion, rengör den första droppen. Placera en fin droppe på en ruta och smet som tidigare förklarats. För den tjocka pärlan, placera en stor pärla på en annan glid och sprid ut på en 1,55 mm fyrkant. Låt de två uttorkningarna torka.
Smetfärgning
För dem med fina droppar kan bland annat Giemsa eller Wright fläckar användas. Giemsa eller May-Grunwald Giemsa-fläck rekommenderas för tjocka utstryk.
Giemsa fläck
Smet fixeras i 3 minuter med metanol, dräneras och får torka igen. Utstrykningen täcks sedan med Giemsa-fläck i 10-15 minuter. Den tvättas med destillerat vatten och får torka. För att observera under mikroskopet placeras en droppe nedsänkningsolja.
Wrights fläck
Smetan täcks av Wrights fläck i 5 minuter. Kassera och placera buffertlösningen vid pH 6,8 i 6 minuter. Blås beredningen för att homogenisera. Tvätta med destillerat vatten och låt torka. Observera under mikroskopet.
Defekta smettyper
Finns i praktikanter för fin droppteknik med bilder.
Smörj ut med områden med olika tjocklekar (tunna och tjocka mellanrum)
Det beror på att den utförda rörelsen inte var konstant under spridningen, vilket gjorde stopp och startar om.
Mycket kort smetstryck
De har två orsaker: den ena beror på att markrutschbanan har lyfts innan den når den andra änden av rutschbanan. I det här fallet är den extremt tjock och kort.
Å andra sidan, om utstrykningen är kort men tunn, beror det på droppens storlek var mycket liten..
Smörj med ett rakat område mot slutet av utstrykningen
Det har flera orsaker: den ena är att markkanten är defekt, att trycket som utövas på mottagarglaset ökas vid spridningstidpunkten eller att slipkanten slits.
Smörj ut med bildandet av vakuoler eller klara rundade eller elliptiska områden
De beror på användning av oljiga utstryk (dåligt tvättade och avfettade).
Mycket tjocka eller mycket tunna utstryk
Droppar som är för stora kommer att ge mycket tjocka utstryk från början till slut och mycket små droppar kommer att ge mycket fina utstryk.
Histologi
Blodceller kan ses i blodutstryk. Bland dem är:
-Erytrocyter eller röda blodkroppar
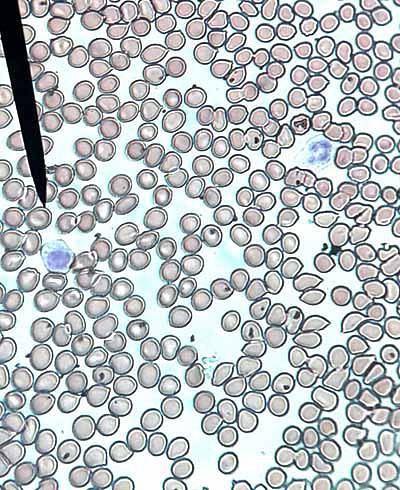
Antalet erytrocyter eller röda blodkroppar är cirka 5 x 106 mm3 hos människa och 4,5 x 106 hos kvinnor. Röda blodkroppar är formade som bikonkava skivor, med en central fysiologisk blekhet. Kan ses separat (normal) eller stapling i rouleaux (onormal).
Smear visar också poikilocytos (röda blodkroppar i olika former), anisocytos (röda blodkroppar i olika storlekar), anisopoikilocytos (olika former och storlekar), anisokromi (olika färger), erytroblaster (omogna röda blodkroppar), mikrocytos (mindre röda blodkroppar)) och makrocyter (större erytrocyter).
När de uppvisar en brist i mängden hemoglobin och den centrala blekheten ökar, sägs det att det finns hypokromi. När en normal röd serie observeras kommer den att rapporteras som normocytisk och normokrom..
-Vita blodkroppar eller leukocyter
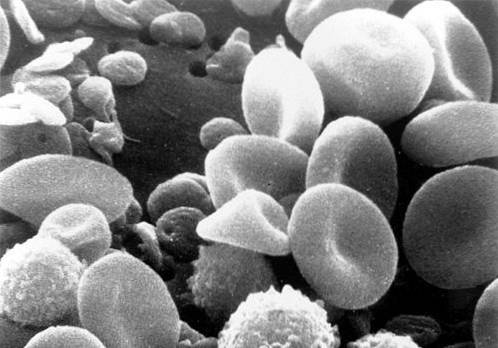
Den normala mängden varierar från 5 000 till 10 000 mm3. De förändras i infektiösa processer, i allergier och i leukemi. I blodutstrykningen kan flera typer urskiljas, vilka förklaras nedan.
Segmenterade neutrofiler
De representerar 55-65% av de totala leukocyterna. De mäter mellan 10-15 μm. De har en segmenterad eller flikad kärna som antar olika morfologier, därför kallas den polymorfonukleär.
De har rikligt med neutrofila granuler i cytoplasman och vissa azurofiler. Ökning av bakterieinfektioner (neutrofili), minskning av virusinfektioner (neutropeni).
Morfologiska avvikelser såsom pleokaryocytos (hyper-segmenterade kärnor), båge (omogna celler) eller makropoliciter (ovalformade och stora) kan observeras..
Andra förändringar:
-Giftiga granuleringar
-Pseudo Pelger neutrofiler (kärnan är obelagd eller bilobed).
-Döhle-kroppar: mörkblå cytoplasmiska inneslutningar.
-Ökad cytoplasmatisk basofili.
-Intracytoplasmiska vakuoler.
-Cellulär pyknos (förlust av kärnbryggor).
Segmenterade eosinofiler
De representerar 1-3% av de totala vita blodkropparna. De mäter 9-10 μm. De kännetecknas av närvaron av rikligt med acidofila cytoplasmiska granuler och få azurofiler. Dess kärna har två lobulationer. Deras antal ökar i allergier och sjukdomar av parasitiskt ursprung.
Segmenterade basofiler
De är extremt sällsynta och representerar 0-1% av leukocyterna. De mäter 10-12μm. Kärnan är vanligtvis oregelbunden i gränser och kan vara bilobed, men den observeras inte på grund av det stora antalet basofila grova granuleringar i dess cytoplasma. Mycket sällan kan basofili ses.
Lymfocyter
De är små celler med basofil cytoplasma, med en väldefinierad, rund kärna, med kondenserat kromatin. Kärnan omfattar nästan hela cellen. De representerar 26-40% av blodleukocyterna. De ökar i virusinfektioner (lymfocytos). Reaktiva lymfocyter kan ses.
Monocyter
Celler större än lymfocyter, med större cytoplasma och lösare ovala kromatinkärnor. De mäter 9-12μm. Cytoplasman är riklig och verkar vanligtvis blekgråblå med standardfärgningstekniker. Vakuolerade monocyter och monocytos kan observeras bland förändringarna..
-Blodplättar
De mäter mellan 1,5-3 μm. Dess form är rund eller oval. Det normala värdet sträcker sig från 150 000 till 350 000 blodplättar / mm3. De kan minska i vissa virusinfektioner. De har ingen kärna och är färgade lila. Avvikelser kan ses i denna serie, såsom makro- eller mikroplättar, trombocytos eller trombocytopeni och trombocytfragment.
Patologiska element
Hematiska parasiter
Hemoparasiter, såsom det orsakande medlet för malaria eller malaria (parasiter av släktet Plasmodium), kan ses i blodutstryk. Av denna anledning är det viktigt att smetan analyseras manuellt, eftersom automatiserad utrustning förbiser detta resultat..
Bakterie
I patologier som återfall av feber eller Lyme-sjukdom kan dess orsakande medel observeras. I det här fallet motsvarar det spiroketerna Borrelia recurrenti Ändå Borrelia burgdorferi i blodutstrykningen.
Omogna celler
Allvarliga fall observeras bland annat i leukemier, leukemoidreaktioner och leukoarytroblastiska reaktioner. Vid bakterieinfektioner kan det finnas små avvikelser till vänster (närvaron av skurkar). Erytroblaster kan också ses i vissa anemier.
Referenser
- Blod och hematopoetisk vävnad. Finns på: sld.cu
- Gomez A, Casas M. 2014. Ängel. Klinisk tolkning av laboratoriet. 8: e upplagan. Panamerikansk medicinsk ledare.
- Solari Soto L, Soto Tarazona A, Mendoza Requena D, Llanos Accounts A. Jämförelse av parasitdensiteter i tjockt venöst blodfall mot akupressur vid diagnosen Malaria vivax. Rev Med Hered 2002; 13 (4): 140-143. Tillgänglig på: scielo.org.
- Terry Leonard Nelson, Mendoza Hernández Carlos. Betydelsen av studien av perifert blodutstryk hos äldre. Medisur 2017; 15 (3): 362-382. Finns på: scielo.sld
- Grinspan S. Studien av perifert blodutstryk. Fortsatt medicinsk utbildning. Finns på: bvs.hn/RMH



Ingen har kommenterat den här artikeln än.