
Ädelgassegenskaper, konfiguration, reaktioner, användningar

De ädelgaser De är en uppsättning element som finns i grupp 18 i det periodiska systemet. Under åren har de också kallats sällsynta eller inerta gaser, som båda är felaktiga; några av dem är mycket rikliga utanför och på planeten Jorden, och de kan också reagera under extrema förhållanden.
Dess sju element utgör kanske den mest unika gruppen i det periodiska systemet, vars egenskaper och låga reaktiviteter är lika imponerande som ädelmetallernas. Bland dem paraderar det mest inerta elementet (neon), det näst vanligaste av kosmos (helium) och det tyngsta och mest instabila (oganeson).

Ädelgaser är de kallaste ämnena i naturen; tål mycket låga temperaturer före kondensering. Ännu svårare är dess frysning, eftersom dess intermolekylära krafter baserade på Londons spridning och polariserbarheten hos dess atomer är för svaga för att knappt hålla dem sammanhängande i en kristall..
På grund av sin låga reaktivitet är de relativt säkra gaser att lagra och utgör inte för många risker. De kan dock förskjuta syre från lungorna och orsaka kvävning om de inandas för mycket. Å andra sidan är två av dess medlemmar mycket radioaktiva element och därför dödliga för hälsan..
Den låga reaktiviteten hos ädelgaser används också för att ge reaktionerna en inert atmosfär; så att inget reagens eller produkt riskerar att oxidera och påverka syntesens prestanda. Detta gynnar också processer för bågsvetsning.
Å andra sidan är de i sina flytande tillstånd utmärkta kryogena köldmedier som garanterar de lägsta temperaturerna, nödvändiga för korrekt drift av mycket energisk utrustning, eller för att vissa material når tillstånd av supraledning..
Artikelindex
- 1 Egenskaper hos ädelgaser
- 2 De 7 ädelgaserna
- 3 Elektronisk konfiguration
- 4 polariserbarhet
- 5 Reaktioner
- 5.1 Helium och neon
- 5.2 Argon och krypton
- 5.3 Xenon och radon
- 6 Produktion
- 6.1 Luftvätska
- 6.2 Destillation av naturgas och radioaktiva mineraler
- 7 Faror
- 8 användningsområden
- 8.1 Industri
- 8.2 Ballonger och andningstankar
- 8.3 Medicin
- 8.4 Övriga
- 9 Referenser
Ädelgasegenskaper
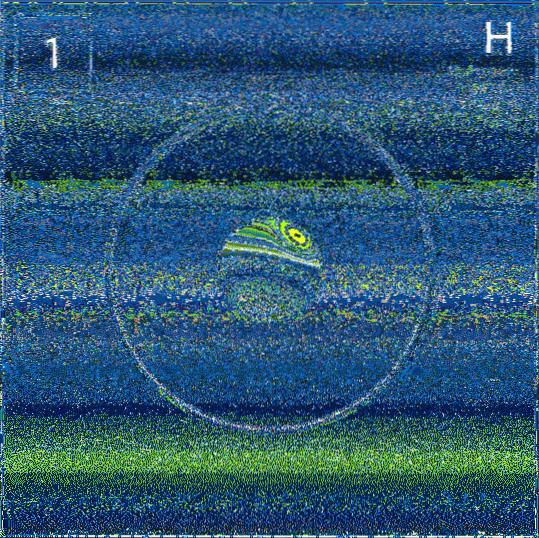
Kanske ädelgaser är de element som har de flesta gemensamma kvaliteter, både fysiska och kemiska. Dess huvudsakliga egenskaper är:
- Alla är färglösa, luktfria och smaklösa; men när de är inneslutna i ampuller vid lågt tryck och de får en elektrisk stöt, joniserar de och avger färgglada lampor (toppbild).
- Varje ädelgas har sitt eget ljus och spektrum.
- De är monatomiska arter, de enda i det periodiska systemet som kan existera i deras respektive fysiska tillstånd utan deltagande av kemiska bindningar (eftersom metaller förenas med metallbindning). Därför är de perfekta för att studera gasernas egenskaper, eftersom de anpassar sig mycket väl till den sfäriska modellen för en idealgas..
- Dessa är i allmänhet elementen med de lägsta smält- och kokpunkterna; så mycket att helium inte ens kan kristallisera vid absolut noll utan tryckökning.
- Av alla element är de minst reaktiva, ännu mindre än ädla metaller.
- Deras joniseringsenergier är de högsta, liksom deras elektronegativiteter, förutsatt att de bildar rent kovalenta bindningar..
- Dess atomeradier är också de minsta eftersom de ligger i de högra ändarna av varje period..
De 7 ädelgaserna
De sju ädelgaserna faller uppifrån och ner genom grupp 18 i det periodiska systemet:
-Helium, han
-Neon, Ne

-Argon, Ar
-Krypton, Kr
-Xenon, Xe

-Radon, Rn
-Oganeson, Og
Alla, utom den instabila och konstgjorda oganesonen, har studerats för deras fysiska och kemiska egenskaper. Oganeson antas på grund av sin stora atommassa inte ens vara en gas utan en ädel vätska eller fast substans. Lite är känt om radon på grund av dess radioaktivitet i förhållande till helium eller argon.
Elektronisk konfiguration
Ädla gaser har sagts ha sitt valensskal helt fyllt. Så mycket så att deras elektroniska konfigurationer används för att förenkla andra element genom att använda deras symboler i hakparenteser ([He], [Ne], [Ar], etc.). Dess elektroniska konfigurationer är:
-Helium: 1stvå, [He] (2 elektroner)
-Neon: 1stvå2stvå2 s6, [Ne] (10 elektroner)
-Argon: 1stvå2stvå2 s63stvå3p6, [Ar] (18 elektroner)
-Krypton: 1stvå2stvå2 s63stvå3p63d104stvå4p6, [Kr] (36 elektroner)
-Xenon: 1stvå2stvå2 s63stvå3p63d104stvå4p64d105stvå5 s6, [Xe] (54 elektroner)
-Radon: 1stvå2stvå2 s63stvå3p63d104stvå4p64d104f145stvå5 s65 d106stvå6p6, [Rn] (86 elektroner)
Det viktiga är att inte komma ihåg dem utan att detaljera att de slutar på nstvånp6: valensoktet. På samma sätt inses det att dess atomer har många elektroner, som på grund av den stora effektiva kärnkraften finns i en mindre volym jämfört med de andra elementens; det vill säga deras atomradier är mindre.
Därför uppvisar deras elektroniskt täta atomradier en kemisk egenskap som alla ädelgaser delar: de är svåra att polarisera..
Polariserbarhet
Ädelgaser kan föreställas som sfärer av elektronmoln. Medan de faller ner genom grupp 18 ökar dess radier och på samma sätt avståndet som skiljer kärnan från valenselektronerna (de hos nstvånp6).
Dessa elektroner, genom att känna en mindre attraktiv kraft från kärnans sida, kan röra sig mer fritt; sfärerna deformeras lättare ju mer voluminösa de är. Som en konsekvens av sådana rörelser uppträder regioner med låga och höga elektrontätheter: δ + och δ-polerna-.
När atomen i en ädelgas är polariserad blir den en momentan dipol som kan framkalla en annan till den angränsande atomen; vi står inför Londons spridande krafter.
Det är därför intermolekylära krafter ökar från helium till radon, vilket återspeglas i deras ökande kokpunkter; och inte bara det, utan deras reaktiviteter ökar också.
När atomer blir mer polariserade finns det en större möjlighet att deras valenselektroner deltar i kemiska reaktioner, varefter ädelgasföreningar genereras..
Reaktioner
Helium och neon
Bland de ädla gaserna är de minst reaktiva helium och neon. I själva verket är neon det mest inerta elementet av alla, även om dess elektronegativitet (från att bilda kovalenta bindningar) överstiger den för fluor.
Ingen av dess föreningar är kända under markförhållanden; Men i kosmos är förekomsten av den molekylära jonen HeH ganska sannolik+. På samma sätt, när de är elektroniskt upphetsade, kan de interagera med gasformiga atomer och bilda kortlivade neutrala molekyler som kallas excimerer; såsom HeNe, CsNe och Netvå.
Å andra sidan, även om de inte betraktas som föreningar i formell mening, kan He- och Ne-atomer ge upphov till Van der Walls-molekyler; det vill säga föreningar som hålls "tillsammans" helt enkelt av dispersiva krafter. Till exempel: Ag3Han, HeCO, HeItvå, CF4Ne, Ne3Cltvå och NeBeCO3.
På samma sätt kan sådana Van der Walls-molekyler existera tack vare svaga joninducerade dipolinteraktioner; till exempel: Na+jag har8, Rb+Han, Cu+Ne3 och Cu+Ne12. Observera att det till och med är möjligt för dessa molekyler att bli agglomerat av atomer: kluster.
Och slutligen kan He- och Ne-atomer "fångas" eller interkaleras i endohedrala komplex av fullerener eller klatrater utan att reagera; till exempel: [e-postskyddad]60, (Ntvå)6Ne7, Han (HtvåELLER)6 och Ne • NH4Fe (HCOO)3.
Argon och krypton
Ädelgaserna argon och krypton, eftersom de är mer polariserbara, tenderar att presentera fler "föreningar" än helium och neon. En del av dem är dock mer stabila och karaktäriserande eftersom de har en längre livslängd. Bland några av dem finns HArF och den molekylära jonen ArH+, närvarande i nebulosor genom verkan av kosmiska strålar.
Från krypton börjar möjligheten att erhålla föreningar i extrema men hållbara förhållanden. Denna gas reagerar med fluor enligt följande kemiska ekvation:
Kr + F.två → KrFtvå
Observera att krypton förvärvar ett oxidationsnummer på +2 (Krtvå+) tack vare fluor. KrFtvå i själva verket kan den syntetiseras i marknadsförbara mängder som ett oxidations- och fluoreringsmedel.
Argon och krypton kan skapa en bred repertoar av klatrater, endohedralkomplex, Van der Walls-molekyler och några föreningar som väntar på upptäckt efter deras förutsagda existens..
Xenon och radon
Xenon är bland de ädla gaserna kungen av reaktivitet. Det bildar de verkligt stabila, säljbara och karaktäriserande föreningarna. Faktum är att dess reaktivitet liknar den hos syre under lämpliga förhållanden..
Hans första syntetiserade förening var ”XePtF6", 1962 av Neil Bartlett. Detta salt bestod faktiskt enligt litteraturen av en komplex blandning av andra fluorerade salter av xenon och platina.
Detta var dock mer än tillräckligt för att visa affiniteten mellan xenon och fluor. Bland några av dessa föreningar har vi: XeFtvå, XeF4, XeF6 och [XeF]+[PtF5]-. När XeF6 löser sig i vatten, genererar en oxid:
XeF6 + 3 HtvåO → XeO3 + 6 HF
Denna XeO3 kan komma från arten känd som xenatos (HXeO4-) eller xeninsyra (HtvåXeO4). Xenates oproportionerliga till perxenates (XeO64-); och om mediet sedan surgörs i peroxensyra (H4XeO6), som dehydratiseras till xenontetroxid (XeO4):
H4XeO6 → 2 HtvåO + XeO4
Radon borde vara den mest reaktiva av ädelgaserna; Men det är så radioaktivt att det knappast har tid att reagera innan det går sönder. De enda föreningarna som har syntetiserats helt är dess fluorid (RnFtvå) och oxid (RnO3).
Produktion
Flytande av luft
Ädelgaserna blir rikligare i universum när vi går ner genom grupp 18. I atmosfären är emellertid helium knappt, eftersom jordens gravitationsfält inte kan behålla det till skillnad från andra gaser. Det var därför det inte upptäcktes i luften utan i solen.
Å andra sidan finns det anmärkningsvärda mängder argon i luften som kommer från radioisotopets radioaktiva förfall 40K. Luft är den viktigaste naturliga källan till argon, neon, krypton och xenon på planeten.
För att producera dem måste luften först kondenseras så att den kondenseras till en vätska. Därefter genomgår denna vätska en fraktionerad destillation, vilket separerar var och en av komponenterna i dess blandning (Ntvå, ELLERtvå, COtvå, Ar, etc.).
Beroende på hur låg temperaturen och gasens överflöd måste vara, ökar dess priser och rankar xenon som det dyraste, medan helium är det billigaste..
Destillation av naturgas och radioaktiva mineraler
Helium erhålls å sin sida från en annan fraktionerad destillation; men inte från luften utan från naturgas, berikad med helium tack vare frisättningen av alfapartiklar från de radioaktiva mineralerna torium och uran.
På samma sätt "föddes" radon från det radioaktiva sönderfallet av radium i sina respektive mineraler; men på grund av deras lägre överflöd och den korta halveringstiden för Rn-atomerna, är deras överflöd skrattretande jämfört med deras kongeners (de andra ädelgaserna).
Och slutligen är oganeson en mycket radioaktiv, ultramassisk, konstgjord ädel "gas" som bara kan existera kort under kontrollerade förhållanden inom ett laboratorium..
Faror
Den största risken för ädelgaser är att de begränsar människans syreanvändning, särskilt när en atmosfär med en hög koncentration av dem produceras. Det är därför det inte rekommenderas att andas in dem för mycket..
I USA har en hög koncentration av radon upptäckts i jordar rik på uran, vilket på grund av dess radioaktiva egenskaper kan utgöra en hälsorisk.
Applikationer
Industri
Helium och argon används för att skapa en inert atmosfär för skydd under svetsning och skärning. Dessutom används de vid tillverkning av kiselhalvledare. Helium används som fyllgas i termometrar.
Argon, i kombination med kväve, används vid tillverkning av glödlampor. Krypton blandat med halogener, såsom brom och jod, används i urladdningslampor. Neon används i ljussignaler, blandat med fosfor och andra gaser för att tona dess röda färg.
Xenon används i båglampor som avger ljus som liknar dagsljus, som används i bilstrålkastare och projektorer. Ädelgaserna blandas med halogener för att producera ArF, KrF eller XeCl, som används vid framställning av excimerlasrar.
Denna typ av laser producerar kortvågs ultraviolett ljus som ger högprecisionsbilder och används vid tillverkning av integrerade kretsar. Helium och neon används som kryogena kylgaser.
Ballonger och andningstankar
Helium används som ersättning för kväve i andningsgasblandningen på grund av dess låga löslighet i kroppen. Detta undviker bildandet av bubblor under dekompressionsfasen under uppstigningen, förutom att kvävnarkosen elimineras.
Helium har ersatt väte som gasen som möjliggör höjning av luftskepp och luftballonger, eftersom det är en lätt och icke-brännbar gas..
Medicin
Helium används vid tillverkning av supraledande magneter som används i kärnmagnetisk resonansutrustning: ett multiverktygsverktyg inom medicin.
Krypton används i halogenlampor som används vid laserögonkirurgi och angioplastik. Helium används för att underlätta andning hos astmatiska patienter.
Xenon används som ett bedövningsmedel på grund av dess höga lipidlöslighet och anses vara framtidens bedövningsmedel. Xenon används också i lungmedicinsk bildbehandling.
Radon, en radioaktiv ädelgas, används i strålterapi för vissa typer av cancer.
Andra
Argon används vid syntes av föreningar som ersätter kväve som den inerta atmosfären. Helium används som bärargas i gaskromatografi, liksom i Geiger-räknare för att mäta strålning.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Helmenstine, Anne Marie, Ph.D. (06 juni 2019). Ädla gasegenskaper, användningsområden och källor. Återställd från: thoughtco.com
- Wikipedia. (2019). Ädelgas. Återställd från: en.wikipedia.org
- Philip Ball. (18 januari 2012). Omöjlig kemi: Tvinga ädelgaser att fungera. Återställd från: newscientist.com
- Professor Patricia Shapley. (2011). Ädelgaskemi. Återställd från: butane.chem.uiuc.edu
- Gary J. Schrobilgen. (28 februari 2019). Ädelgas. Encyclopædia Britannica. Återställd från: britannica.com


Ingen har kommenterat den här artikeln än.