
Heliumhistoria, egenskaper, struktur, risker, användningsområden
De helium är ett kemiskt grundämne vars symbol är Han. Det är den första ädelgasen i det periodiska systemet och ligger vanligtvis längst till höger om den. Under normala förhållanden är det en inert gas, eftersom ingen av dess få föreningar är stabila; Det expanderar också mycket snabbt och är ämnet med den lägsta kokpunkten av alla.
På en populär nivå är det en välkänd gas, eftersom det i vanliga evenemang eller barnfester är vanligt att bevittna hur en ballong stiger tills den försvinner på himlen. Men vad som verkligen och för alltid är förlorat i solsystemets hörn, och bortom, är heliumatomerna som släpps ut när ballongen exploderar eller tömmar..

Det finns faktiskt de som, och med goda skäl, anser att heliumballonger utgör en olämplig metod för denna gas. Lyckligtvis har den viktigare och intressantare användningar tack vare dess fysiska och kemiska egenskaper som skiljer den från andra kemiska element..
Till exempel är flytande helium så kallt att det kan frysa vad som helst, som en metalllegering, vilket gör det till ett supraledande material. På samma sätt är det en vätska som manifesterar överflödighet, som kan klättra uppför en glasbehållares väggar..
Dess namn beror på att det identifierades för första gången på solen och inte på jorden. Det är det näst vanligaste elementet i hela universumet, och även om dess koncentration är försumbar i jordskorpan, kan det erhållas från reserverna av naturgas och radioaktiva mineraler av uran och torium..
Här visar helium ett annat märkligt faktum: det är en gas som är mycket rikligare i undergrunden än i atmosfären, där den hamnar på att fly från jorden och dess gravitationsfält.
Artikelindex
- 1 Historia
- 2 Fysikaliska och kemiska egenskaper
- 2.1 Utseende
- 2.2 Atomnummer (Z)
- 2.3 Molmassa
- 2.4 Smältpunkt
- 2.5 Kokpunkt
- 2.6 Densitet
- 2.7 Trippelpunkt
- 2.8 Kritisk punkt
- 2.9 Fusionsvärme
- 2.10 Förångningsvärme
- 2.11 Molär värmekapacitet
- 2.12 Ångtryck
- 2.13 Joniseringsenergier
- 2.14 Löslighet
- 2.15 Reaktivitet
- 2.16 oxidationsnummer
- 3 Struktur och elektronisk konfiguration
- 3.1 Dimrar
- 3.2 Helium II
- 3.3 Kristaller
- 4 Var att hitta och få
- 4.1 Kosmos och stenar
- 4.2 Luft och hav
- 4.3 Flytande och destillation av naturgas
- 5 isotoper
- 6 risker
- 7 användningsområden
- 7.1 Tryck- och avluftningssystem
- 7.2 Läckagedetektering
- 7.3 Bärgas
- 7.4 Ballonger och blimps
- 7.5 Dykning
- 7.6 Bågsvetsar
- 7.7 Supraledare
- 8 Referenser
Berättelse
Helium upptäcktes inte på jorden utan på solen. Faktum är att det kommer från det grekiska ordet "helios" som betyder sol. Elementets existens i sig kontrasterade Dmitri Mendeleevs periodiska system, eftersom det inte fanns någon plats i det för en ny gas; det vill säga, då misstänktes ingenting om ädelgaser.
Namnet 'helium', skrivet som 'helium' på engelska, slutade med att suffixet -ium hänvisade till det som en metall; just för att det inte kunde tillåtas att det finns en annan gas än syre, väte, fluor, klor och kväve.
Detta namn utsågs av den engelska astronomen Norman Lockyer, som studerade från England vad som observerades av den franska astronomen Jules Janssen i Indien, under en solförmörkelse 1868.
Det var en gul spektrallinje av ett hittills okänt element. Lockyer hävdade att detta berodde på närvaron av ett nytt kemiskt element som finns i solen.
1895, nästan tjugo år senare, kände den skotska kemisten Sir William Ramsay igen samma spektrum från en restgas när han studerade ett radioaktivt mineral: cleveite. Så det fanns helium här också på jorden.
Fysiska och kemiska egenskaper
Utseende
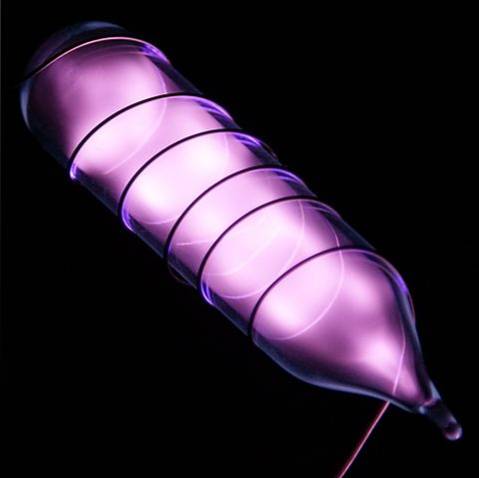
Helium är en färglös, luktfri gas som inte har smak och är också inert. Men när en elektrisk stöt appliceras och beroende på spänningsskillnaden börjar den glöda som en grå-lila dis (bilden ovan) och sedan lysa med en orange glöd. Därför är heliumlamporna orange.
Atomnummer (Z)
två
Molmassa
4,002 g / mol
Smältpunkt
-272,2 ºC
Kokpunkt
-268,92 ºC
Densitet
-0,1786 g / L, under normala förhållanden, det vill säga i gasfasen.
-0,155 g / ml, vid smältpunkt, flytande helium.
-0,125 g / ml, precis som helium börjar koka.
-0,187 g / ml, vid 0 K och 25 atm, dvs fast helium vid de specifika tryck- och temperaturförhållandena.
Trippel punkt
2177 K och 5043 kPa (0,04935 atm)
Kritisk punkt
5.1953 K och 0.22746 MPa (2.2448 atm)
Fusionsvärme
0,0138 kJ / mol
Förångningsvärme
0,0829 kJ / mol
Molär värmekapacitet
20,78 J / (mol K)
Ångtryck
0,9869 atm vid 4,21 K. Detta värde ger dig en uppfattning om hur flyktig helium kan vara och hur lätt det kan fly från rumstemperatur (nära 298 K).
Joniseringsenergier
-Först: 2372,3 kJ / mol (He+ gasformig)
-Andra: 5250,5 kJ / mol (Hetvå+ gasformig)
Joniseringsenergierna för helium är särskilt höga eftersom gasatomen måste förlora en elektron, som upplever en stark effektiv kärnkraftsladdning. Det kan också förstås genom att ta hänsyn till atomens lilla storlek och hur "nära" de två elektronerna är till kärnan (med sina två protoner och två neutroner).
Löslighet
I vatten löses 0,97 ml för varje 100 ml vatten vid 0 ºC, vilket innebär att det är dåligt lösligt.
Reaktivitet
Helium är det näst minst reaktiva kemiska grundämnet i naturen. Under normala förhållanden är det korrekt att säga att det är en inert gas; Aldrig (verkar det) kan en heliumförening manipuleras i ett rum eller laboratorium utan enorma tryck som påverkar den; eller kanske dramatiskt höga eller låga temperaturer.
Ett exempel ser vi i föreningen NatvåHan, som endast är stabil under ett tryck på 300 GPa, reproduceras i en diamantstädcell.
Medan de kemiska bindningarna i NatvåDe är "konstiga" när de har sina elektroner väl placerade i kristallerna, de är långt ifrån enkla Van der Walls-interaktioner och därför består de inte bara av heliumatomer fångade av molekylära aggregat. Det är här dilemmaet uppstår mellan vilka heliumföreningar som är verkliga och vilka som inte är..
Till exempel kan kvävemolekyler vid höga tryck fånga en heliumatom för att bilda ett slags klatrat, He (Ntvå)elva.
På samma sätt finns det endohedrala komplex av fullerenkatjoner, C60+n och C70+n, i vars håligheter de kan rymma heliumatomer; och den molekylära katjonen HeH+ (He-H+), finns i mycket avlägsna nebulosor.
Oxidationsnummer
Vem av nyfikenhet försöker beräkna oxidationsantalet för helium i någon av dess föreningar kommer att upptäcka att detta är lika med 0. I NatvåHan skulle till exempel kunna tro att dess formel motsvarar hypotetiska Na-jonertvå+jag hartvå-; men sådant skulle vara att anta att den har en ren jonisk karaktär, när dess bindningar i verkligheten är långt ifrån så.
Dessutom får helium inte elektroner eftersom det inte kan rymma dem i 2s-omloppet, energiskt otillgängligt; Det är inte heller möjligt för den att förlora dem på grund av dess atoms storlek och kärnans stora effektiva kärnladdning. Det är därför helium alltid deltar (i teorin) som en atom He0 i dess härledda föreningar.
Struktur och elektronisk konfiguration
Helium upptar, liksom alla gaser som observeras i makroskala, volymen på behållarna som lagrar det och har således en obestämd form. Men när temperaturen sjunker och börjar svalna under -269 ° C kondenseras gasen till en färglös vätska; helium I, den första av de två flytande faserna för detta element.
Anledningen till att helium kondenserar vid en så låg temperatur beror på de låga spridningskrafterna som håller sina atomer samman; oavsett fas. Detta kan förklaras med dess elektroniska konfiguration:
1stvå
I vilka två elektroner ockuperar 1s atombanan. Heliumatomen kan visualiseras som en nästan perfekt sfär, vars homogena elektroniska periferi är lite benägen för polarisering av den effektiva kärnladdningen för de två protonerna i kärnan..
Således är spontana och inducerade dipolmoment sällsynta och mycket svaga; så temperaturen måste närma sig absolut noll så att He-atomerna närmar sig långsamt och uppnår att deras dispersiva krafter definierar en vätska; eller ännu bättre, en heliumkristall.
Dimers
I gasfasen är utrymmet som separerar He-atomerna sådant att det kan antas att de alltid är åtskilda från varandra. Så mycket att helium i en liten volymflaska verkar färglös tills det utsätts för en elektrisk urladdning, som joniserar sina atomer i en gråaktig och inte särskilt ljus dimma..
Men i den flytande fasen kan Atomer, inte ens med deras svaga interaktioner, inte längre "ignoreras". Nu låter dispersionskraften dem tillfälligt gå samman för att bilda dimerer: He-He eller Hetvå. Därför kan helium jag betraktas som stora kluster av Hantvå i jämvikt med dess atomer i ångfasen.
Det är därför helium I är så svårt att skilja från dess ångor. Om denna vätska spillts ut ur den lufttäta behållaren, flyr den ut som en vitaktig bloss..
Helium II
När temperaturen sjunker ännu mer, vid 2 178 K (-270 972 ºC), inträffar en fasövergång: helium I förvandlas till helium II.
Från denna punkt blir den redan fascinerande heliumvätskan en superfluid eller kvantvätska; det vill säga deras makroskopiska egenskaper manifesteras som om dimererna Hantvå de var enskilda atomer (och kanske är de). Den saknar fullständig viskositet, eftersom det inte finns någon yta som kan stoppa en atom under dess glidning eller "klättring".
Det är därför helium II kan klättra upp i väggarna i en glasbehållare och övervinna tyngdkraften; oavsett hur höga de är, så länge ytan förblir vid samma temperatur och därför inte förångas.
På grund av detta kan flytande helium inte förvaras i glasbehållare, eftersom det skulle fly ut vid minsta spricka eller gap. mycket lik hur det skulle hända med en gas. Istället används rostfritt stål för att designa sådana fartyg (Dewars-tankar).
Kristaller
Även om temperaturen sjönk till 0 K (absolut noll) skulle spridningskraften mellan He-atomerna inte vara tillräckligt stark för att ge dem en kristallin struktur. För att stelning ska uppstå måste trycket stiga till cirka 25 atm; och sedan uppträder kompakta sexkantiga heliumkristaller (hcp).
Geofysiska studier visar att denna hcp-struktur förblir oförändrad oavsett hur mycket tryck ökar (upp till storleksordningen gigapascal, GPa). Det finns emellertid ett smalt område i deras tryck-temperaturdiagram där dessa hcp-kristaller genomgår en övergång till en kroppscentrerad kubisk fas (bcc)..
Var att hitta och få
Kosmos och stenar

Helium är det näst vanligaste grundämnet i hela universum, näst bara väte. Stjärnor producerar ständigt omätbara mängder heliumatomer genom fusion av två vätekärnor under nukleosyntesprocessen..
På samma sätt är varje radioaktiv process som avger α-partiklar en källa för produktion av heliumatomer om de interagerar med elektronerna i miljön; till exempel med de av en stenig kropp i avlagringar av radioaktiva mineraler av uran och torium. Dessa två element genomgår radioaktivt sönderfall, som börjar med uran:
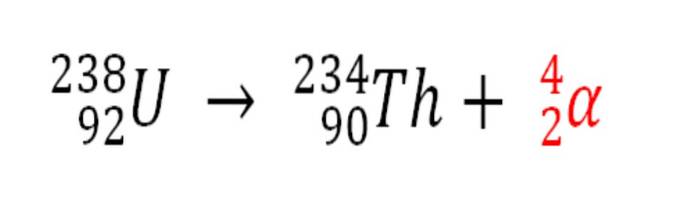
Därför kommer heliumatomerna att fångas i bergarterna där dessa radioaktiva mineraler är koncentrerade, vilka kommer att frigöras när de smälts i sura medier..
Bland några av dessa mineraler är cleveit, karnotit och uraninit, alla sammansatta av uranoxider (UOtvå eller U3ELLER8) och torium, tungmetaller och sällsynta jordartsmetaller. Helium, bevattnat genom underjordiska kanaler, kan hamna i naturgasreservoarer, mineralfjädrar eller i meteoriska järn.
Det beräknas att en massa helium motsvarande 3000 ton produceras årligen i litosfären, från det radioaktiva sönderfallet av uran och torium..
Luft och hav
Helium är inte särskilt lösligt i vatten, så snarare än senare hamnar det upp från djupet (varhelst dess ursprung är) tills det passerar atmosfärens lager och slutligen når yttre rymden. Dess atomer är så små och lätta att jordens gravitationsfält inte kan behålla dem i atmosfären..
På grund av ovanstående är koncentrationen av helium både i luften (5,2 ppm) och i haven (4 ppt) mycket låg..
Om vi ville extrahera den från något av dessa två medier, skulle det "bästa" alternativet vara luft, som först måste utsättas för kondensering för att kondensera alla dess gaser, medan helium förblir i gasform..
Det är dock inte praktiskt att få helium från luften utan från stenar berikade med radioaktiva mineraler; eller ännu bättre, från naturgasreserver, där helium kan utgöra upp till 7% av dess totala massa.
Flytande och destillation av naturgas
Istället för att kondensera luften är det lättare och mer lönsamt att använda naturgas, vars heliumkomposition utan tvekan är mycket större. Således är råmaterialet par excellence (kommersiellt) för erhållande av helium naturgas, som också kan utsättas för fraktionerad destillation.
Den slutliga produkten av destillationen avslutas genom rening med aktivt kol, genom vilket ett mycket rent helium passerar igenom. Och slutligen separeras helium från neon genom en kryogen process där flytande helium används..
Isotoper
Helium förekommer främst i naturen som isotopen 4Han, vars nakna kärna är den berömda α-partikeln. Denna atom av 4Han har två neutroner och två protoner. I mindre överflöd är isotopen 3Han, som bara har en neutron. Den första är tyngre (har en högre atommassa) än den andra.
Således är isotopparet 3Jag har och 4Han är de som definierar de mätbara egenskaperna och vad vi förstår om helium som ett kemiskt grundämne. Sedan 3Han är lättare, det antas att dess atomer har högre kinetisk energi och att de därför behöver en ännu lägre temperatur för sammanhållning i en superfluid.
De 3Han anses vara en mycket sällsynt art här på jorden; på månjord är det dock rikligare (ungefär 2000 gånger mer). Det är därför månen har varit föremål för projekt och berättelser som en möjlig källa till 3Han, som skulle kunna användas som kärnbränsle för framtidens rymdfarkoster.
Bland andra isotoper av helium kan följande nämnas med deras respektive halveringstid: 5Jag har (t1/2= 7,610−22 s), 6Jag har (t1/2= 0,8 s) och 8Jag har (t1/2= 0,119 s).
Risker
Helium är en inert gas och deltar därför inte i någon av de reaktioner som sker i våra kroppar..
Dess atomer kommer praktiskt taget in och ut andas ut utan att deras interaktioner med biomolekyler ger en efterföljande effekt; med undantag för ljudet från stämbanden, som blir högre och har högre frekvens.
Människor som andas in helium från en ballong (med måtta) talar med en hög röst, liknar den hos en ekorre (eller anka).
Problemet är att om han andas in en olämplig mängd helium, riskerar han att kvävas, eftersom dess atomer förskjuter syremolekylerna; och därför kommer du inte att kunna andas förrän du andas ut allt helium, vilket i sin tur på grund av dess tryck kan riva lungvävnaden eller orsaka barotrauma.
Fall av människor som har dött av inhalation av helium har rapporterats på grund av vad som just har förklarats.
Å andra sidan, även om det inte utgör en brandrisk med tanke på dess brist på reaktivitet mot syre (eller ett annat ämne), kan det läckage vara fysiskt farligt om det lagras under högt tryck och det flyr ut..
Applikationer
Heliums fysikaliska och kemiska egenskaper gör det inte bara till en speciell gas utan också till ett mycket användbart ämne för applikationer som kräver extremt låga temperaturer. I detta avsnitt kommer några av dessa applikationer eller användningar att tas upp..
Tryck- och avluftningssystem
I vissa system är det nödvändigt att öka trycket (trycksätta), och för detta måste en gas injiceras eller tillföras som inte interagerar med någon av dess komponenter; t.ex. med reagens eller ytor som är känsliga för oönskade reaktioner.
Således kan trycket ökas med volymer helium, vars kemiska tröghet gör det idealiskt för detta ändamål. Den inerta atmosfären som det underlättar överstiger i vissa fall kväve.
För den omvända processen, det vill säga rensningen, används helium också på grund av dess förmåga att transportera allt syre, vattenångor eller någon annan gas, vars närvaro du vill ta bort. På detta sätt minskar trycket i systemet när helium har tömts..
Läckagedetektering
Helium kan läcka genom den minsta sprickan, så det tjänar också till att upptäcka läckage i rör, högvakuumbehållare eller kryogentankar.
Ibland kan detektering göras visuellt eller genom beröring; dock är det mestadels en detektor som "ger" signalen om var och hur mycket helium som flyr från systemet under inspektion..
Bärargas
Heliumatomer, som nämnts för rensningssystem, kan bära med sig, beroende på deras tryck, tyngre molekyler. Till exempel används denna princip dagligen i gaskromatografianalys, eftersom den kan dra det finfördelade provet längs kolonnen, där det interagerar med den stationära fasen..
Ballonger och luftskepp

På grund av dess låga densitet jämfört med luft och återigen dess brist på reaktivitet med syre har den använts för att blåsa upp ballonger på barnfester (blandat med syre så att ingen kvävs från att andas det) och luftskepp (toppbild), utan att det utgör en brandrisk.
Dykning

När dykare sjunker ner till större djup har de svårt att andas på grund av det stora trycket som utövas av vattnet. Det är därför som helium tillsätts till deras syretankar för att minska densiteten hos den gas som dykare andas och andas ut, och därmed kan den andas ut med mindre arbete..
Bågsvetsar
I svetsprocessen ger den elektriska ljusbågen tillräckligt med värme för att de två metallerna ska komma ihop. Om det görs under en heliumatmosfär reagerar inte glödmetallen med syret i luften för att bli dess respektive oxid; därför förhindrar helium att detta händer.
Supraledare
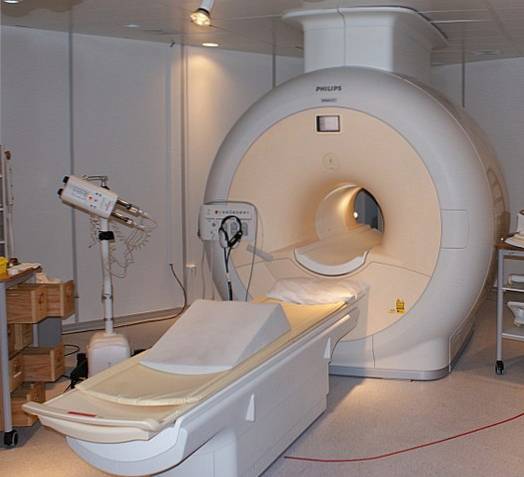
Flytande helium är så kallt att det kan frysa metaller i superledare. Tack vare detta har det varit möjligt att tillverka mycket kraftfulla magneter, som, kylda med flytande helium, har använts i bildskannrar eller kärnmagnetiska resonansspektrometrar..
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Andy Extance. (17 april 2019). Heliumhydridjon detekterad i rymden för första gången: bevis hittades för svårfångad kemi från universums första minuter. Återställd från: chemistryworld.com
- Peter Wothers. (19 augusti 2009). Helium. Kemi i sitt element. Återställd från: chemistryworld.com
- Wikipedia. (2019). Helium. Återställd från: en.wikipedia.org
- Mao, H. K., Wu, Y., Jephcoat, A. P., Hemley, R. J., Bell, P. M., & Bassett, W. A. (1988). Kristallstruktur och täthet av Helium upp till 232 Kbar. Återställd från: articles.adsabs.harvard.edu
- Nationellt centrum för bioteknikinformation. (2019). Helium. PubChem-databas. CID = 23987. Återställd från: pubchem.ncbi.nlm.nih.gov
- Mary-Ann Muffoletto. (6 februari 2017). Upp, upp och bort: Kemister säger "ja", helium kan bilda föreningar. Utah State University. Återställd från: phys.org
- Steve Gagnon. (s.f.). Isotoper av Element Helium. Jefferson Lab. Återställd från: education.jlab.org
- Advameg, Inc. (2019). Helium. Återställd från: chemistryexplained.com



Ingen har kommenterat den här artikeln än.