
Cyklopropan (C3H6) Struktur, egenskaper, användningar och risker

De cyklopropan är en cyklisk molekyl som har molekylformeln C3H6, och består av tre kolatomer bundna ihop i form av en ring. Inom kemi finns en familj av mättade kolväten som har ett skelett som består av kolatomer förenade med enkelbindningar i form av en ring..
Denna familj består av ett varierat antal molekyler (som skiljer sig åt längden på deras huvudsakliga kolkedja), och är kända för att ha högre smält- och kokpunkter än de för höga kedjor, samt en större reaktivitet än dessa..
Cyklopropan upptäcktes 1881 av en österrikisk kemist vid namn August Freund, som var fast besluten att veta vad som var det giftiga grundämnet i eten och som kom att tro att det var samma cyklopropan..
Trots det började det produceras på industriell nivå förrän på 1930-talet, då de upptäckte dess användningsområden som anestesi, för innan den tiden fann de det inte kommersiellt attraktivt.
Artikelindex
- 1 Kemisk struktur
- 2 fastigheter
- 2.1 Kokpunkt
- 2.2 Smältpunkt
- 2.3 Densitet
- 2.4 Reaktivitet
- 3 användningsområden
- 4 risker
- 5 Referenser
Kemisk struktur
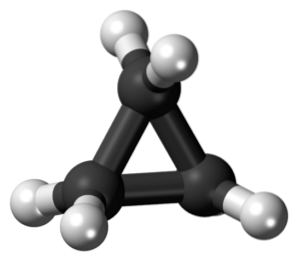
Cyklopropan, med molekylformel C3H6, Den består av tre små kolatomer som sammanfogar en konfiguration så att en ring bildas och lämnar en molekylär symmetri av D3h på varje kol i kedjan.
Strukturen för denna molekyl kräver att bindningsvinklarna som bildas är cirka 60 °, mycket mindre än de 109,5 ° som observeras mellan sp-hybridatomer.3, vilket är en mer termodynamiskt stabil vinkel.
Detta leder till att ringen lider av en mer signifikant strukturell spänning än andra strukturer av denna typ, förutom en naturlig torsionsspänning som den har på grund av den förmörkade konformationen av dess väteatomer..
Av samma skäl är bindningarna som bildas mellan kolatomerna i denna molekyl betydligt svagare än i vanliga alkaner..
På ett märkligt sätt och till skillnad från andra bindningar där närheten mellan två molekyler symboliserar större bindningsenergi, har bindningarna mellan kolerna i denna molekyl en särskild egenskap att de har en kortare längd än de andra alkanerna (på grund av deras geometri) och samtidigt med tiden är de svagare än fackföreningarna mellan dessa.
Vidare har cyklopropan stabiliteten genom cyklisk avlokalisering av de sex elektronerna i kol-kolbindningarna, vilket är något mer instabilt än cyklobutan och betydligt mer än cyklohexan..
Egenskaper
Kokpunkt
Jämfört med de andra vanligaste cykloalkanerna har cyklopropan den lägsta kokpunkten bland dessa typer av molekyler, som förångar vid 33 grader under noll (inga andra cykloalkaner flyktar vid temperaturer under noll).
Å andra sidan, jämfört med linjär propan, har cyklopropan en högre kokpunkt: den flyktar vid 42 ° C under noll, något lägre än den för dess cykloalkankusin.
Smältpunkt
Smältpunkten för cyklopropan är lägre än för andra cykloalkaner och smälter vid en temperatur av 128 ºC lägre än noll. Ändå är det inte den enda cykloalkanen som smälter vid en temperatur under noll, och detta fenomen kan också observeras i cyklobutan, cyklopentan och cykloheptan..
Så när det gäller linjär propan smälter den vid en temperatur lägre än 187 ° C under noll..
Densitet
Cyklopropan har den högsta densiteten bland cykloalkaner, mer än två gånger högre än den tätaste vanliga cykloalkanen (1,879 g / l för cyklopropan, överstiger cyklodekan med 0,871).
En högre densitet observeras också i cyklopropan än i linjär propan. Skillnaden i kok- och smältpunkter mellan linjära alkaner och cykloalkaner beror på högre Londonkrafter, som ökas av ringformen som möjliggör en större kontaktyta mellan inre atomer..
Reaktivitet
Cyklopropanmolekylens reaktivitet påverkas direkt av dess bindnings svaghet, vilket ökar avsevärt jämfört med andra cykloalkaner på grund av effekten av den spänning som utövas på dessa bindningar..
Tack vare detta kan cyklopropan separeras lättare och kan fungera som en alken i vissa reaktioner. Faktum är att den extrema reaktiviteten hos cyklopropan-syreblandningar kan bli en explosionsrisk..
Applikationer
Den kommersiella användningen av cyklopropan par excellence är som ett bedövningsmedel och studerar denna egenskap för första gången 1929.
Cyklopropan är ett kraftfullt, snabbverkande bedövningsmedel som inte irriterar luftvägarna eller har en dålig lukt. Den användes i flera decennier tillsammans med syre för att somna patienter under operationen, men oönskade biverkningar började observeras, representerade som "cyklopropanchock.".
Tillsammans med kostnader och höga antändningsfaktorer genomgick det en process för att kasta och ersätta med andra säkrare bedövningsmedel..
Även om det fortsatte att vara en del av de föreningar som används vid induktion av anestesi, är det idag inte en del av de medel som används i medicinska applikationer.
Risker
- Cyklopropan är en mycket brandfarlig gas som producerar giftiga gaser när den kommer i kontakt med en låga. Dessutom kan den reagera med oxidationsmedel såsom perklorater, peroxider, permanganater, nitrater och halogener, vilket orsakar bränder och / eller explosioner..
- Höga nivåer av cyklopropan kan orsaka huvudvärk, yrsel, illamående, koordinationsförlust, svimningskänsla och / eller yr..
- Det kan också leda till oregelbunden hjärtrytm eller arytmi, andningssvårigheter, koma och till och med döden..
- Den flytande cyklopropanen kan orsaka frostskador på huden på grund av dess temperatur betydligt under noll.
- Eftersom det är en gas under omgivande förhållanden kan denna förening enkelt tränga in i kroppen genom luften och det minskar också syrenivån i luften..
Referenser
- Britannica, E. (s.f.). Cyklopropan. Hämtad från britannica.com
- Kemi, O. (s.f.). Cyklopropansyntes. Återställd från organisk-kemi.org
- ChemSpider. (s.f.). Cyklopropan. Hämtad från chemspider.com
- Wagnières, O. (s.f.). Cyklopropaninnehållande naturprodukter. Återställd från lspn.epfl.ch
- Wikipedia. (s.f.). Cyklopropan. Hämtad från en.wikipedia.org



Ingen har kommenterat den här artikeln än.