
Hexokinasstrukturer, funktioner, former

De hexokinas (HK) är det enzym som katalyserar den första reaktionen av den glykolytiska vägen i praktiskt taget alla levande organismer, både prokaryoter och eukaryoter. Den ansvarar för överföringen av en fosforylgrupp till glukos, vilket producerar glukos-6P, även om den också kan fosforylera andra sockerarter hexoser (6 kolatomer).
Detta enzym klassificeras inom en av de två familjerna av glukokinasenzymer (enzymer som överför fosforylgrupper till substrat såsom glukos): hexokinas (HK) -familjen, vars medlemmar är indelade i tre olika grupper som kallas HK-gruppen, gruppen A och grupp B.
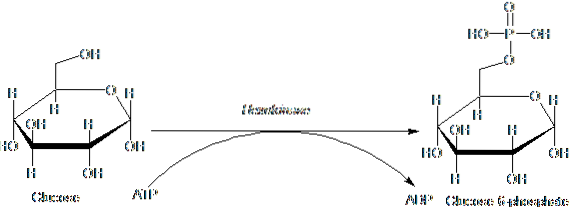
Enzymerna som tillhör HK-familjen kännetecknas av fosforylerande glukos på bekostnad av ATP som en fosforylgruppsgivarmolekyl, och dess medlemmar skiljer sig åt huvudsakligen med avseende på deras molekylvikt och substratspecificitet..
HK-gruppen inkluderar enzymer från eukaryota organismer (ATP: D-hexos 6-fosfotransferaser), medan grupp A representeras av enzymerna av gramnegativa bakterier, cyanobakterier, amitokondriatprotister och trypanosomatider, och grupp B innehåller enzymerna grampositiva bakterier och crenoqueotiska organismer.
Grupp A- och B-enzymer är också kända som glukokinaser (GlcKs), eftersom de uteslutande kan fosforylera glukos, varför dessa enzymer kallas ATP: D-glukos 6-fosfotransferaser.
Som ett glykolytiskt enzym har hexokinas stor metabolisk betydelse, eftersom utan den skulle denna viktiga väg inte vara möjlig och celler som är mycket beroende av kolhydratkonsumtion, såsom hjärnan och muskelceller hos många däggdjur, skulle ha allvarliga funktionella och fysiologiska hinder i allmänhet.
Artikelindex
- 1 Struktur
- 2 funktioner
- 2.1 I växter
- 3 former
- 4 Referenser
Strukturera
Som kommer att framgå senare finns olika typer av hexokinaseenzymer hos däggdjur och andra ryggradsdjur (liksom i encelliga organismer såsom jäst). Hos däggdjur har fyra beskrivits: isoformer I, II, III och IV.
De tre första isozymerna har 100 kDa molekylvikt, men isozym IV har 50 kDa. Dessa isoenzymer (särskilt I-III) uppvisar hög sekvenslikhet mellan dem med avseende på deras C- och N-terminaler, liksom med andra medlemmar av hexokinasfamiljen..
Den N-terminala domänen för dessa enzymer anses vara den "reglerande" domänen, medan den katalytiska aktiviteten utförs av den C-terminala domänen (däggdjurs HK II har aktiva platser i båda domänerna).
Den N-terminala domänen är kopplad till den C-terminala domänen genom en alfa-helix, var och en är ungefär 50 kDa i molekylvikt och har ett bindningsställe för glukos.
Den tertiära strukturen för dessa enzymer består väsentligen av P-vikta ark blandade med alfa-helixer, vars andel varierar med avseende på enzymet och arten i fråga; bindningsstället för ATP, det andra substratet för hexokinas, består vanligtvis av fem β-ark och två alfa-helixer.
Funktioner
Hexokinas har en transcendental funktion i kolhydratmetabolismen hos de flesta levande varelser, eftersom det katalyserar det första steget i den glykolytiska vägen och förmedlar fosforyleringen av glukos inuti cellen..
Detta första steg av glykolys, som består av överföringen av en fosforylgrupp från ATP (givare) till glukos, vilket ger glukos 6-fosfat och ADP, är det första av de två energianvändningsstegen i form av ATP.
Vidare är reaktionen katalyserad av hexokinas steget "aktivering" av glukos för dess efterföljande bearbetning och representerar ett steg av "engagemang", eftersom glukosen sålunda fosforylerad inte kan lämna cellen med hjälp av dess konventionella transportörer i membranet..
Produkten från reaktionen katalyserad av hexokinas, det vill säga glukos 6-fosfat, är en grenpunkt, eftersom det är det första substratet som används i pentosfosfatvägen och i syntesen av glykogen hos många djur (och stärkelsen i växter).
I växterna
Funktionen av hexokinas i växter skiljer sig inte särskilt mycket från djur eller mikroorganismer, men i högre växter fungerar detta enzym också som en "sensor" för koncentrationen av sockerarter..
Betydelsen av denna funktion i dessa organismer har att göra med sockers deltagande som regleringsfaktorer i uttrycket av gener som är involverade i olika metaboliska processer, såsom:
- Fotosyntes
- Glyoxylatcykeln
- Andningen
- Nedbrytning eller syntes av stärkelse och sackaros
- Kväveomsättning
- Försvar mot patogener
- Reglering av cellcykeln
- Det helande svaret
- Pigmentering
- Åldrande, bland andra.
Denna funktion av hexokinas som en "sensor" för mängden intracellulärt glukos har också beskrivits för jäst och däggdjur..
Former
I naturen finns det olika former av hexokinaser och detta beror i grunden på arten som anses.
Hos människa och andra ryggradsdjur har till exempel förekomsten av fyra olika isoformer av hexokinasenzymet i det cytosoliska avdelningen visats, vilka har betecknats med de romerska siffrorna I, II, III och IV.
Isoenzymer I, II och III har en molekylvikt på 100 kDa, inhiberas av deras reaktionsprodukt (glukos 6-fosfat) och är mycket glukosrelaterade, det vill säga de har en mycket låg Km-konstant. Dessa enzymer har emellertid dålig substratspecificitet och kan fosforylera andra hexoser såsom fruktos och mannos..
Isoenzym IV, även känt som glukokinas (GlcK), har endast 50 kDa i molekylvikt och trots att det är dåligt besläktat (höga Km-värden) har det en hög specificitet för glukos som substrat och utsätts inte för dem. de andra tre isoenzymerna.
Glukokinas (isoenzym IV i hexokinas hos många däggdjur) finns främst i levern och hjälper detta organ vid "justering" av glukosförbrukningen som svar på variationer av detta substrat i det cirkulerande blodet..
De tre gener som kodar för hexokinaser I, II och III hos djur verkar ha samma 50 kDa förfader som duplicerades och smälte i genomet, vilket verkar uppenbart när det observeras att den katalytiska aktiviteten hos formerna I och III endast ligger vid C-terminaländen.
Referenser
- Aronoff, S. L., Berkowitz, K., Shreiner, B., & Want, L. (2004). Glukosmetabolism och reglering: bortom insulin och glukagon. Diabetes spektrum, 17(3), 183-190.
- Harrington, G. N., & Bush, D. R. (2003). Den bifunktionella rollen av hexokinas i metabolism och glukos signalering. Växtcellen, femton(11), 2493-2496.
- Jang, J. C., León, P., Zhou, L., & Sheen, J. (1997). Hexokinase som sockersensor i högre växter. Växtcellen, 9(1), 5-19.
- Kawai, S., Mukai, T., Mori, S., Mikami, B., & Murata, K. (2005). Hypotes: strukturer, utveckling och förfader till glukokinaser i hexokinasfamiljen. Journal of Bioscience and Bioengineering, 99(4), 320-330.
- Mathews, K. E. (1998). Van Holde. Biokemi.
- Wilson, J. E. (2003). Isozymer av däggdjurshexokinas: struktur, subcellulär lokalisering och metabolisk funktion. Journal of Experimental Biology, 206(12), 2049-2057.



Ingen har kommenterat den här artikeln än.