
Vad är hydrolys och exempel på reaktioner

De hydrolys Det är en kemisk reaktion som kan inträffa i både oorganiska och organiska molekyler eller joner, och som involverar deltagande av vatten för att bryta deras bindningar. Dess namn härstammar från grekiska, "hydro" av vatten och "lys" av bristning.
Vattenmolekylen, HtvåEller det skapar en jämvikt med jonerna av salter av svaga syror och baser, detta koncept visas för första gången i allmänna kemistudier och analytisk kemi. Det är därför en av de enklaste kemiska reaktionerna.
I flera exempel på hydrolys kan inte vatten ensamt bryta en viss kovalent bindning. När detta händer accelereras eller katalyseras processen genom försurning eller alkalisering av mediet; det vill säga i närvaro av H-joner3ELLER+ u OH-, respektive. På samma sätt finns det enzymer som katalyserar hydrolys.
Hydrolys intar en speciell plats när det gäller biomolekyler, eftersom bindningarna som håller samman sina monomerer är känsliga för hydrolys under vissa förhållanden. Till exempel hydrolyseras sockerarter för att bryta ner polysackarider till deras beståndsdelar monosackarider tack vare effekten av glukosidasenzymer..
Artikelindex
- 1 Vad är hydrolys?
- 2 Exempel på hydrolysreaktioner
- 2.1 - ATP
- 2.2 - Vatten
- 2.3 - Proteiner
- 2.4 - Amider och estrar
- 2,5 - Syrabas
- 3 Referenser
Vad är hydrolys?
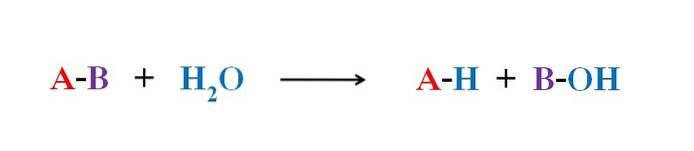
Bilden ovan förklarar vad hydrolys består av. Observera att inte bara molekylen eller substratet (om enzymer förmedlar) bryter sin bindning utan också själva vattnet som "bryter" in i H+ och OH-, där H+ slutar med A och OH- med B. A-B reagerar sålunda med en vattenmolekyl som producerar två produkter, A-H och B-OH.
Hydrolys är därför motsatt reaktion mot kondens. I kondensen förenas två produkter, för att säga A-H och B-OH, genom frigörandet av en liten molekyl: vattnet. Vid hydrolys förbrukas en molekyl, medan den i kondens frigörs eller produceras.
Återgå till exemplet med socker, antag att A-B motsvarar en sackarosdimer, där A representerar glukos och B representerar fruktos. Bindningen A-B, glykosid, kan hydrolyseras så att de härrör från de två monosackariderna separat och i lösning, och detsamma händer med oligo och polysackarider om enzymer förmedlar i sådana reaktioner.
Observera att i denna reaktion, A-B, har pilen bara en riktning; det vill säga det är en irreversibel hydrolys. Men många hydrolyser är faktiskt reversibla reaktioner som når en jämvikt.
Exempel på hydrolysreaktioner
- ATP
ATP är stabilt mellan pH-värden på 6,8 och 7,4. Men vid extrema pH-värden hydrolyserar den spontant. Hos levande varelser katalyseras hydrolys av enzymer som kallas ATPaser:
ATP + HtvåO => ADP + Pi
Denna reaktion är starkt exergonisk, eftersom entropin för ADP är större än för ATP. Variationen av Gibbs fria energi (ΔGº) är - 30,5 kJ / mol. Energin som produceras genom hydrolys av ATP används i många endergoniska reaktioner.
Kopplade reaktioner
I vissa fall används hydrolysen av ATP för omvandling av en förening (A) till en förening (B).
A + ATP + HtvåELLER <=> B + ADP + Pi + H+
- Vatten
Två vattenmolekyler kan reagera med varandra vid uppenbar hydrolys:
HtvåO + HtvåELLER <=> H3ELLER+ + Åh-
Det är som om en av dessa vattenmolekyler bröts in i H+ och OH-, kommer att länka H+ till syreatomen i den andra vattenmolekylen, vilket ger upphov till hydroniumjonen, H3ELLER+. Denna reaktion handlar mer än hydrolys om autojonisering eller autoprotolys av vatten.
- Protein
Proteiner är stabila makromolekyler och för att uppnå fullständig hydrolys krävs det extrema förhållanden i aminosyrorna som utgör dem. såsom en koncentration av saltsyra (6 M) och höga temperaturer.
Levande varelser är dock utrustade med en enzymatisk arsenal som möjliggör hydrolys av proteiner till aminosyror i tolvfingertarmen. Enzymerna som är involverade i proteinklyvning utsöndras nästan helt av bukspottkörteln.
Det finns exopeptidasenzymer som bryter ner proteiner, som börjar vid deras ändar: aminopeptidas vid aminoänden och karboxypeptidas i karboxyländen. Endopeptidasenzymer utövar sin verkan inuti proteinkedjan, till exempel: trypsin, pepsin, chymotrypsin, etc..
- Amider och estrar
Amider ger upphov till en karboxylsyra och en amin när de värms upp i ett alkaliskt medium:
RCONHtvå + HtvåO => RCOO- + NHtvå
Estrar i ett vattenhaltigt medium hydrolyseras till en karboxylsyra och en alkohol. Förfarandet katalyseras av antingen en bas eller en syra:
RCO-OR '+ HtvåO => RCOOH + R'OH
Detta är den berömda förtvålningsreaktionen.
- Syra bas
I vatten hydrolyseras flera arter för att göra det vattenhaltiga mediet surt eller alkalisera.
Tillsätt ett basalt salt
Natriumacetat, ett basiskt salt, dissocieras i vatten för att ge Na-joner+ (natrium) och CH3KUTTRA- (acetat). Dess basicitet beror på det faktum att acetat hydrolyseras för att generera OH-joner-, medan natrium förblir oförändrat:
CH3KUTTRA- + HtvåELLER <=> CH3COOH + OH-
OH- är ansvarig för att pH stiger och blir grundläggande.
Tillsätt ett syrasalt
Ammoniumklorid (NH4Cl) bildas av kloridjonen (Cl-från saltsyra (HCl), en stark syra och ammoniumkatjonen (NH4+från ammoniumhydroxid (NH4OH), en svag bas. Cl- Det dissocieras inte i vatten, men ammoniumkatjonen förvandlas till vatten enligt följande:
NH4+ + HtvåELLER <=> NH3 + H3ELLER+
Hydrolysen av ammoniumkatjonen producerar protoner som ökar surheten i ett vattenhaltigt medium, så det dras slutsatsen att NH4Cl är ett surt salt.
Tillsätt ett neutralt salt
Natriumklorid (NaCl) är en saltprodukt från reaktionen mellan en stark bas (NaOH) och en stark syra (HCl). Genom att lösa upp natriumklorid i vatten kan natriumkatjonen (Na+) och anjonen (Cl-). Båda jonerna dissocieras inte i vatten, så de lägger inte till H+ u OH-, håller dess pH konstant.
Därför sägs natriumklorid vara ett neutralt salt..
Referenser
- Mathews, C. K., van Holde, K. E. och Ahern, K. G. (2002). Biokemi. (Tredje upplagan). Redigera. Pearson-Addison Wesley.
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Helmenstine, Anne Marie, Ph.D. (13 januari 2019). Hydrolys: Definition och exempel. Återställd från: thoughtco.com
- Theresa Phillips. (28 april 2019). En förklaring av hydrolysprocessen. Återställd från: thebalance.com
- Redaktörerna för Encyclopaedia Britannica. (2016, 16 november). Hydrolys. Encyclopædia Britannica. Återställd från: britannica.com
- Wikipedia. (2019). Hydrolys. Återställd från: en.wikipedia.org

Ingen har kommenterat den här artikeln än.