
Aromatiska kolväteegenskaper, exempel, tillämpningar

De aromatiska kolväten eller aren är en uppsättning organiska föreningar som endast består av kol och väten och som kännetecknas av att de har bensenringenheter i sina molekylära strukturer.
Vissa, som namnet betonar, avger söta och behagliga dofter; varför de första organiska kemisterna kallade dem aromater. Metangas är till exempel ett luktfritt kolväte; medan toluen, en flyktig vätska, har en ganska märklig och stark lukt.
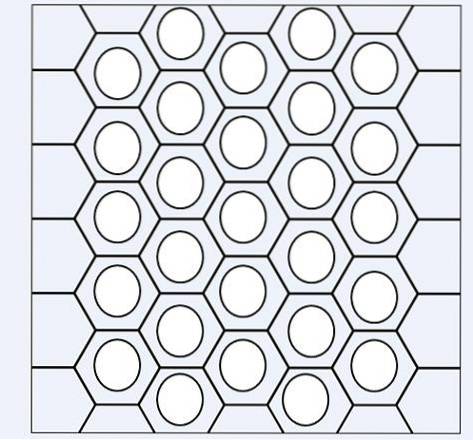
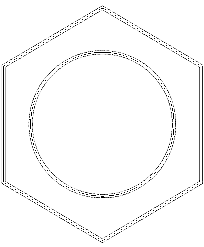
I bilden ovan har vi ett slags nätverk eller nät som består av bensenringar. Notera dess sexkantiga geometrier och cirkeln inuti. Denna cirkel representerar vad som kallas aromaticitet, vilket är en helt kemisk och icke-fysisk egenskap, oberoende av lukten från dessa kolväten..
Aromatiska kolväten är bland de viktigaste ämnena, extraherade eller producerade, från petroleum- och kolmineraler. Bensen är hörnstenen för dessa kolväten och deras tillämpningar, eftersom den härrör från oändliga föreningar som används som råmaterial för produktion av gödselmedel, plast, lim, tvättmedel, parfymer, läkemedel etc..
Artikelindex
- 1 Hur heter aromatiska kolväten??
- 1.1 En enda bensenring
- 1.2 Flera ringar
- 2 Egenskaper hos aromatiska kolväten
- 2.1 Aromatisitet
- 2.2 Höga C / H-förhållanden
- 2.3 Gula lågor
- 2.4 Substitutionsreaktioner
- 2.5 Dofter
- 3 Exempel på aromatiska kolväten
- 4 Applikationer / användningar
- 4.1 Fibrer och plast
- 4.2 Epoxihartser
- 4.3 Tvättmedel
- 4.4 TNT
- 4.5 Bensoesyra
- 4.6 Lösningsmedel
- 4.7 Bensin
- 5 Referenser
Hur heter aromatiska kolväten??
En enda bensenring
För aromatiska kolväten har vi det särdrag att deras traditionella eller vanliga namn tenderar att råda framför de som styrs av IUPAC-nomenklaturen.
De innehåller alla bensenringen eller en ring som uppfyller aromatisitetsegenskapen. Det enklaste kan nämnas baserat på bensen och dess relativa positioner.
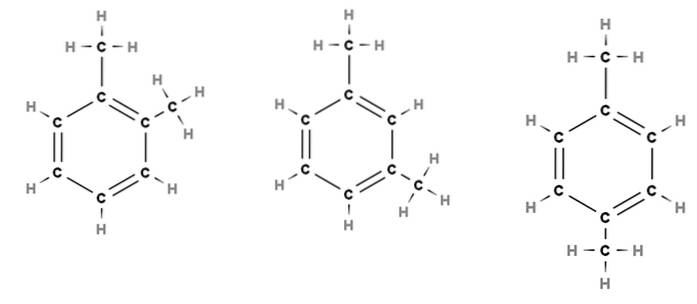
Tänk till exempel på bilden ovan. I de tre strukturerna ser vi den sexkantiga ringen av bensen, som har två metylsubstituenter, CH3. Således kallas denna förening dimetylbensen, eftersom den består av en bensen med två metyler.
Från vänster till höger ser vi att separationen mellan båda CH3 blir äldre, vilket inte bara påverkar molekylens fysiska egenskaper utan också modifierar deras respektive namn. För att skilja dem, eftersom de alla kallas dimetylbensen, används prefixen ortho (o-), meta (m-) och para (p-).
Därför, och igen, från vänster till höger har vi: orto-dimetylbensen, meta-dimetylbensen och para-dimetylbensen. Det traditionella namnet för denna förening är dock xylen, så namnen blir: orto-xylen, meta-xylen och para-xylen..
Om det finns mer än två olika substituenter räknas kolerna enligt samma nomenklaturregler som för alla kolväten.
Flera ringar
För aromatiska kolväten med mer än en bensenring blir de traditionella namnen ännu viktigare. Detta beror på att de systematiska namnen som beskriver deras strukturer är besvärliga och svåra att memorera. Tänk på exemplet med naftalen:
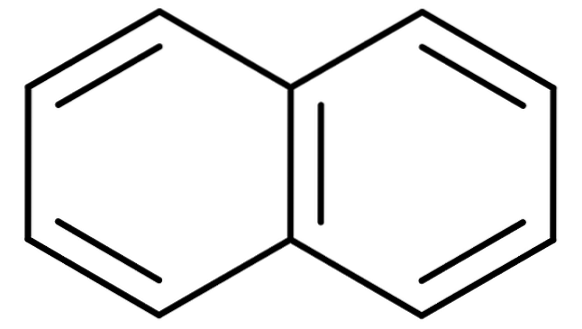
Naftalen är också känd kommersiellt som naftalen eller vit kamfer. Dess systematiska namn är dock: Bicyclo [4,4,0] deca-1,3,5,7,9 pentaen. Och detta endast för en förening med två smälta bensenringar; nomenklaturen blir mycket mer komplicerad för föreningar med tre eller flera ringar.
Egenskaper hos aromatiska kolväten
Aromaticitet
Aromatiska kolväten innehåller ringar som följer Huckels regler. Det vill säga, deras ringar måste ha atomer med sp-hybridiseringartvå, vara så platt som möjligt och ha ett antal avlokaliserade π-elektroner lika med 4n + 2. Till exempel är bensen aromatisk eftersom den har 6 avlokaliserade elektroner till n= 1 (4 · 1 + 2 = 6).
Höga C / H-förhållanden
C / H-förhållandena för aromatiska kolväten är höga eller större än 1. Exempelvis för bensen, C6H6, dess C / H är lika med 6/6 eller 1. Medan för naftalen är C10H8, dess C / H är lika med 10/8 eller 1,25. Vad betyder det här? Att dessa kolväten är mycket "kolsyrade" jämfört med andra föreningar.
Gula lågor
Just på grund av deras höga C / H-förhållanden, när aromatiska kolväten bränns, avger de gulaktiga lågor, en produkt av de bildade kolpartiklarna (sot).
Substitutionsreaktioner
Aromatiska kolväten kan ersätta deras väteatomer med vilken annan substituent som helst. Detta uppnås genom två typer av organiska reaktioner: elektrofil aromatisk substitution (SEAr) eller nukleofil aromatisk substitution (SNAr)..
Dofter
Aromatiska kolväten, som namnet antyder, kännetecknas av att de har söta eller starka lukter. Denna egenskap gjorde det möjligt för dem att i princip skilja sig från gasformiga kolväten och vissa vaxartade paraffiner..
Exempel på aromatiska kolväten
Aromatiska kolväten gäller strängt taget endast de som består av kol och väte. Det bör inte finnas några heteroatomer (O, P, N, S, etc.). Följande exempel som ska nämnas utelämnar därför föreningar såsom pyridin, furan eller fenol..
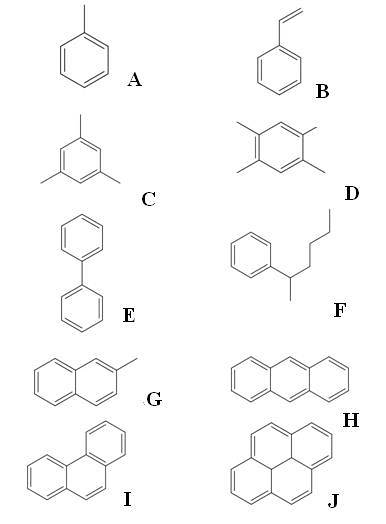
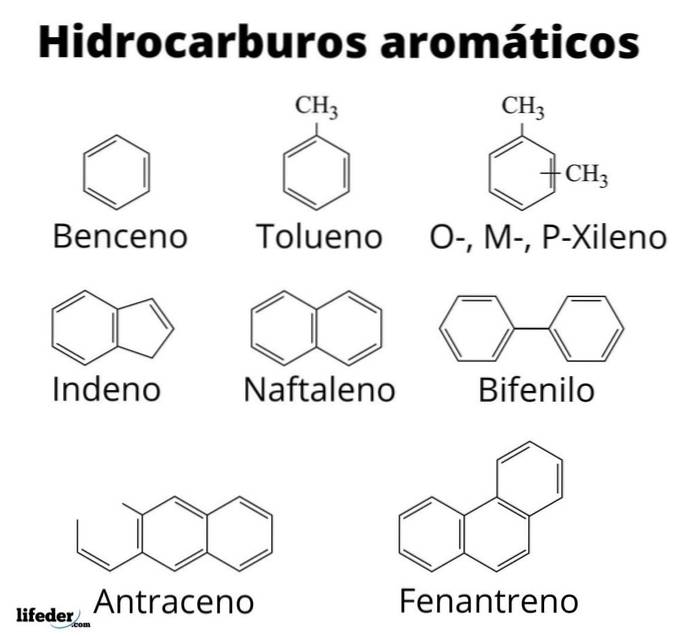
Ovan har vi tio exempel på aromatiska kolväten. Observera att de alla har minst en bensenring. Deras namn är:
A: Toluen
B: Styren
C: Mesitylene
D: Dureno
E: bifenyl
F: 2-fenylhexan
G: 2-metylnaftalen
H: Antracen
I: Fenantren
J: Pyrené
Av dem alla är toluen den med det högsta industriella värdet.
Applikationer / användningar
De flesta tillämpningarna av aromatiska kolväten består i att tjäna som råmaterial för syntes eller produktion av produkter med högt kommersiellt värde. Nästan alla börjar från bensen, som utsätts för olika organiska reaktioner för att erhålla funktionella derivat.
Fibrer och plast
Cyklohexan framställs av bensen, som senare omvandlas till andra föreningar för att syntetisera nylon 6 eller nylon 66. Å andra sidan kan styren, som består av monomeren av polystyren, också erhållas från bensen. Således har vi polymerer som är nödvändiga för produktion av fibrer och plast.
Epoxihartser
Från bensen kan likaså bisfenol A syntetiseras, med vilken epoxihartser, lim, lim och till och med färger framställs genom olika syntetiska vägar..
Tvättmedel
Alkylbensener med långa sidokedjor används för produktion av tvättmedel; inklusive alkylbensensulfonater.
TNT
TNT kan framställas av toluen: trinitrotoluen, ett av de mest kända sprängämnena.
Bensoesyra
Från toluen erhålls bensoesyra som ett derivat, en essentiell förening för beredningar av många parfymer, läkemedel och livsmedel..
Lösningsmedel
Bensen, toluen och xylen (BTX) är de mest använda organiska lösningsmedlen inom petroleumsforskning.
Bensin
Aromatiska kolväten är också en del av bensinens sammansättning och har huvudrollen att höja dess oktantal eller oktantal..
Referenser
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. (10th utgåva.). Wiley plus.
- Carey F. (2008). Organisk kemi. (Sjätte upplagan). Mc Graw Hill.
- Morrison och Boyd. (1987). Organisk kemi. (Femte upplagan). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Aromatisk förening. Återställd från: en.wikipedia.org
- Ed Vitz et al. (8 september 2020). Aromatiska kolväten. Kemi LibreTexts. Återställd från: chem.libretexts.org
- Wyman Elizabeth. (2020). Aromatiska kolväten: definition, exempel och användningar. Studie. Återställd från: study.com
- Boluda, C. J., Macías, M., & González Marrero, J. (2019). Den kemiska komplexiteten hos fordonsbensiner. Vetenskap, teknik och tillämpningar,två(2), 51-79. Doi: doi.org/10.22206/cyap.2019.v2i2.pp51-79



Ingen har kommenterat den här artikeln än.