
Kolegenskaper, struktur, erhållande, användningsområden
De kol Det är ett icke-metalliskt kemiskt grundämne vars kemiska symbol är C. Det beror på sitt namn på kol, grönsaker eller mineraler, där dess atomer definierar olika strukturer. Många författare kvalificerar det som kungen av grundämnena, eftersom det bildar ett brett spektrum av organiska och oorganiska föreningar och också förekommer i ett stort antal allotroper..
Och om detta inte räcker för att hänvisa till det som ett speciellt element, finns det i alla levande varelser; alla dess biomolekyler är skyldiga deras stabilitet och styrka av C-C-bindningar och deras höga tendens att sammanfoga. Kol är livets element och med sina atomer är deras kroppar byggda.

De organiska föreningarna med vilka biomaterial byggs består praktiskt taget av kolskelett och heteroatomer. Dessa kan ses med blotta ögat i träden av träden; och också, när blixtnedslag slår dem och stekar dem. Det återstående inerta svarta fastämnet har också kol; men det handlar om kol.
Således finns det "döda" manifestationer av detta element: kol, en produkt av förbränning i syrefattiga miljöer; och mineral kol, en produkt av geologiska processer. Båda fasta ämnena ser lika ut, de är svarta och de brinner för att generera värme och energi; men med olika avkastning.
Från och med nu är kol det 15: e mest förekommande elementet i jordskorpan. Inte konstigt när miljontals ton kol produceras årligen. Dessa mineraler skiljer sig i sina egenskaper beroende på graden av föroreningar och placerar antracit som mineralkol av högsta kvalitet..
Jordskorpan är inte bara rik på mineralkol utan också på karbonater, särskilt kalksten och dolomiter. Och när det gäller universum är det det fjärde vanligaste elementet; Jag menar, det finns mer kol där ute på andra planeter.
Artikelindex
- 1 Kolens historia
- 1.1 Ser tillbaka
- 1.2 Erkännande
- 2 fastigheter
- 2.1 Grafit vs diamant
- 3 Struktur och elektronisk konfiguration
- 3.1 Hybridiseringar
- 3.2 oxidationsnummer
- 3.3 Molekylära geometrier
- 3.4 Amorfa eller kristallina fasta ämnen
- 4 Skaffa
- 5 användningsområden
- 6 Risker och försiktighetsåtgärder
- 7 Referenser
Kolhistoria
Återblick
Kol kan vara lika gammalt som jordskorpan själv. Sedan urminnes tider har forntida civilisationer stött på detta element i dess många naturliga presentationer: sot, kol, kol, kol, diamanter, grafit, koltjära, antracit etc..
Alla dessa fasta ämnen, även om de delade de mörka tonerna (med undantag av diamant), skilde sig anmärkningsvärt från resten av deras fysiska egenskaper, liksom deras sammansättning. Då var det omöjligt att hävda att de i huvudsak bestod av kolatomer.
Det var alltså att genom historien klassificerades kol efter dess kvalitet när de brände och gav värme. Och med de gaser som bildades av dess förbränning upphettades massor av vatten, vilket i sin tur producerade ångor som flyttade turbiner som genererade elektriska strömmar..
Kol var oväntat närvarande i kol som producerades genom att bränna träd i slutna eller hermetiska utrymmen; i grafiten med vilken pennorna gjordes; i diamanter som används som ädelstenar; var ansvarig för stålets hårdhet.
Dess historia går hand i hand med trä, krut, stadsbelysningsgaser, tåg och fartyg, öl, smörjmedel och andra väsentliga föremål för mänsklighetens framsteg..
Erkännande
Vid vilken tidpunkt kunde forskare associera allotroper och mineraler av kol till samma element? Kol sågs som ett mineral, och det betraktades inte som ett kemiskt grundämne som är värd det periodiska systemet. Det första steget borde ha varit att visa att alla dessa fasta ämnen omvandlades till samma gas: koldioxid, COtvå.
Antoine Lavoisier 1772, med hjälp av en träram med stora linser, fokuserade solens strålar på prover av kol och en diamant. Han upptäckte att ingen av dem bildade vattenångor förutom COtvå. Han gjorde detsamma med sotet och fick samma resultat..
Carl Wilhelm Scheele 1779, fann det kemiska sambandet mellan kol och grafit; det vill säga båda fasta ämnena var sammansatta av samma atomer.
Smithson Tennant och William Hyde Wollaston 1797 verifierade metodiskt (genom reaktioner) att diamant verkligen var sammansatt av kol genom att producera COtvå i dess förbränning.
Med dessa resultat kastades ljus snart på grafit och diamant, fasta ämnen bildade av kol, och därför av hög renhet; till skillnad från de orena fasta ämnena av kol och andra kolhaltiga mineraler.
Egenskaper
De fysikaliska eller kemiska egenskaper som finns i fasta ämnen, mineraler eller kolhaltiga material är föremål för många variabler. Bland dem är: sammansättningen eller graden av föroreningar, hybridiseringarna av kolatomer, mångfalden av strukturerna och porernas morfologi eller storlek..
När egenskaperna hos kol beskrivs är de flesta texter eller bibliografiska källor baserade på grafit och diamant..
Varför? Eftersom de är de mest kända allotroperna för detta element och representerar fasta ämnen eller material med hög renhet; de är praktiskt taget gjorda av inget mer än kolatomer (men med olika strukturer, vilket kommer att förklaras i nästa avsnitt).
Egenskaperna hos kol och mineral träkol skiljer sig åt i ursprung eller sammansättning. Till exempel kryper brunkol (lågt kol) som bränsle jämfört med antracit (högt kol). Och vad sägs om de andra allotroperna: nanorör, fullerener, grafener, graffiner etc..
Kemiskt har de dock en punkt gemensamt: de oxiderar med ett överskott av syre i COtvå:
C + ELLERtvå => COtvå
Nu är hastigheten eller temperaturen de behöver för att oxidera är specifika för var och en av dessa allotroper..
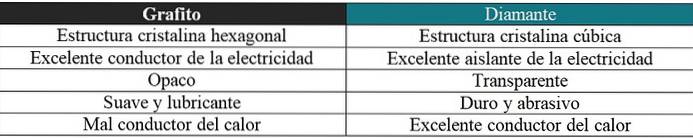
Grafit mot diamant
En kort kommentar kommer också att göras här om de mycket olika egenskaperna för dessa två allotroper:
Struktur och elektronisk konfiguration
Hybridiseringar
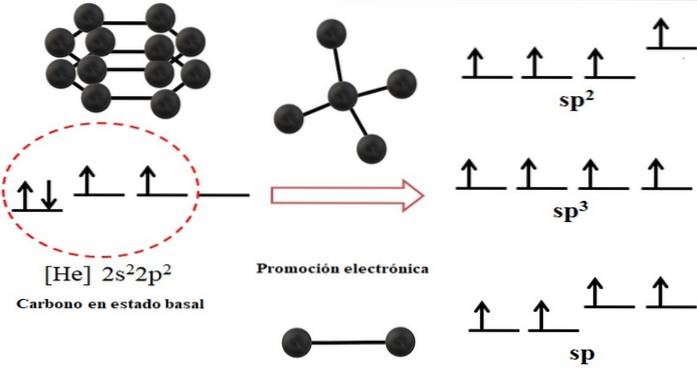
Elektronkonfigurationen för kolatomen är 1stvå2stvå2 stvå, också skrivet som [He] 2stvå2 stvå (översta bilden). Denna representation motsvarar dess marktillstånd: kolatomen isolerad och upphängd i ett sådant vakuum att den inte kan interagera med andra..
Det kan ses att en av dess 2p-orbitaler saknar elektroner, som accepterar en elektron från den andra energin 2s orbital genom elektronisk befordran; och sålunda förvärvar atomen förmågan att bilda upp till fyra kovalenta bindningar genom sina fyra sp hybridorbitaler3.
Observera att de fyra sp-orbitalerna3 de är degenererade i energi (inriktade på samma nivå). Orbitaler sid rena är mer energiska, varför de ligger ovanför de andra hybridorbitalerna (till höger om bilden).
Om det finns tre hybridorbitaler beror det på att en orbital finns kvar sid utan hybridisering; därför är de tre sp-orbitalertvå. Och när det finns två av dessa hybridorbitaler, två orbitaler sid är tillgängliga för att bilda dubbel- eller trippelbindningar, varvid sp-kolhybridisering.
Sådana elektroniska aspekter är väsentliga för att förstå varför kol kan hittas i oändligheten av allotroper..
Oxidationsnummer
Innan du fortsätter med strukturerna är det värt att nämna det, med tanke på valenselektronkonfigurationen 2stvå2 stvå, kol kan ha följande oxidationsnummer: +4, +2, 0, -2 och -4.
Varför? Dessa siffror motsvarar antagandet att en jonbindning existerar så att du bildar jonerna med respektive laddningar; det vill säga C4+, Ctvå+, C0 (neutral), Ctvå- och C4-.
För att kol ska ha ett positivt oxidationsnummer måste det förlora elektroner; och för att göra det måste det nödvändigtvis bindas till mycket elektronegativa atomer (som syre).
För att kol ska ha ett negativt oxidationsnummer måste det få elektroner genom att binda till metallatomer eller mindre elektronegativt än det (såsom väte).
Det första oxidationsnumret, +4, betyder att kolet har tappat alla valenselektroner; 2- och 2p-orbitalerna förblir tomma. Om 2p-banan förlorar sina två elektroner kommer kolet att ha ett oxidationsnummer på +2; om du får två elektroner har du -2; och om du får ytterligare två elektroner genom att fylla i din valensoktet, -4.
Exempel
Till exempel för COtvå oxidationsantalet på kol är +4 (eftersom syre är mer elektronegativt); medan för CH4, är -4 (eftersom väte är mindre elektronegativt).
För CH3OH, oxidationstalet av kol är -2 (+1 för H och -2 för O); medan det för HCOOH är +2 (kontrollera att summan ger 0).
Andra oxidationstillstånd, såsom -3 och +3, är också troliga, särskilt när det gäller organiska molekyler; till exempel i metylgrupperna, -CH3.
Molekylära geometrier
Den övre bilden visade inte bara hybridiseringen av orbitalerna för kolatomen, utan också de resulterande molekylgeometrierna när flera atomer (svarta sfärer) var kopplade till en central. Denna centrala atom för att ha en specifik geometrisk miljö i rymden måste ha respektive kemisk hybridisering som tillåter det..
Till exempel, för tetraeder har det centrala kolet sp-hybridisering3; eftersom sådant är det mest stabila arrangemanget för de fyra sp hybrid-orbitalerna3. När det gäller sp-koltvå, de kan bilda dubbelbindningar och ha en trigonal planmiljö; och så definierar dessa trianglar en perfekt sexkant. Och för en sp-hybridisering antar kolen en linjär geometri.
Således regleras geometrier som observeras i strukturerna för alla allotroper helt enkelt i tetraeder (sp3), hexagoner eller pentagoner (sptvå) och linjer (sp).
Tetrahedra definierar en 3D-struktur, medan hexagoner, pentagoner och linjer, 3D- eller 2D-strukturer; De senare kommer att vara planen eller lakan som liknar bikakornas väggar:

Och om vi viker den sexkantiga väggen (femkantig eller blandad) får vi ett rör (nanorör) eller en boll (fullerener) eller en annan figur. Samspelet mellan dessa siffror ger upphov till olika morfologier.
Amorfa eller kristallina fasta ämnen
Bortsett från geometrier, hybridiseringar eller morfologier för de möjliga strukturerna av kol, kan dess fasta ämnen klassificeras globalt i två typer: amorft eller kristallint. Och mellan dessa två klassificeringar fördelas deras allotroper.
Amorft kol är helt enkelt ett som presenterar en godtycklig blandning av tetraeder, hexagoner eller linjer, som inte kan skapa ett strukturellt mönster; så är fallet med kol, kol eller aktivt kol, koks, sot etc..
Medan det kristallina kolet består av strukturella mönster som bildas av någon av de föreslagna geometrierna; till exempel diamant (tredimensionellt nätverk av tetraeder) och grafit (staplade sexkantiga ark).
Erhållande
Kol kan vara rent som grafit eller diamant. Dessa finns i deras respektive mineralogiska avlagringar, spridda över hela världen och i olika länder. Det är därför som vissa nationer är mer exportörer av ett av dessa mineraler än andra. Kort sagt, "du måste gräva jorden" för att få kol.
Detsamma gäller mineralkol och dess typer. Men detta är inte fallet med kol, eftersom en kropp rik på kol först måste "förgås", antingen under eld eller en elektrisk blixt; naturligtvis i frånvaro av syre, annars skulle CO frigörastvå.
En hel skog är en kolkälla som kol; inte bara för dess träd utan också för dess fauna.
I allmänhet måste prover som innehåller kol genomgå pyrolys (brinnande i frånvaro av syre) för att frigöra en del av föroreningarna som gaser; och sålunda förblir ett fast ämne rikt på kol (amorft eller kristallint) som en rest.
Applikationer
Återigen, liksom egenskaperna och strukturen, överensstämmer användningen eller tillämpningen med de allotroper eller mineralogiska formerna av kol. Det finns dock vissa allmänna egenskaper som kan nämnas, förutom några välkända punkter. Sådana är:
-Kol har länge använts som ett mineralreduktionsmedel för att erhålla rena metaller; exempelvis bland annat järn, kisel och fosfor.
-Det är livets hörnsten, och organisk kemi och biokemi är studierna för denna reflektion..
-Det har också varit ett fossilt bränsle som gjorde det möjligt för de första maskinerna att vrida sina växlar. På samma sätt erhölls koldioxid från den för de gamla belysningssystemen. Kol var synonymt med ljus, värme och energi.
-Blandat som tillsatsmedel med järn i olika proportioner tillät det uppfinningen och förbättring av stål.
-Dess svarta färg ägde rum i konsten, särskilt grafit och alla skrifter gjorda med dess streck..
Risker och försiktighetsåtgärder
Kol och dess fasta ämnen utgör ingen hälsorisk. Vem har någonsin brytt sig om en påse med kol? De säljs i massor i gångarna på vissa marknader, och så länge det inte finns någon eld i närheten kommer deras svarta block inte att brinna..
Koks kan å andra sidan utgöra en risk om svavelhalten är hög. Vid förbränning släpper den ut svavelgaser som, förutom att de är giftiga, bidrar till surt regn. Och även om COtvå i små mängder kan det inte kväva oss, det har en enorm inverkan på miljön som växthusgas.
Ur detta perspektiv är kol en "långsiktig" fara, eftersom dess förbränning förändrar klimatet på vår planet..
Och i en mer fysisk mening transporteras de fasta ämnena eller kolhaltiga materialen lätt om de är pulveriserade med luftströmmar; och följaktligen införs de direkt i lungorna, vilket kan skada dem irreparabelt.
För resten är det mycket vanligt att konsumera "kol" när lite mat tillagas.
Referenser
- Morrison, R. T. och Boyd, R, N. (1987). Organisk kemi. 5: e upplagan. Ledare Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kemi. (Sjätte upplagan). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10: e upplagan.). Wiley plus.
- Andrew. (2019). Kol, dess allotroper och strukturer. Återställd från: everyscience.com
- Advameg, Inc. (2019). Kol. Kemi förklaras. Återställd från: chemistryexplained.com
- Helmenstine, Anne Marie, Ph.D. (11 juli 2018). 10 kolfakta (Atomnummer 6 eller C). Återställd från: thoughtco.com
- Tawnya Eash. (2019). Vad är kol? - Fakta och historielektion för barn. Studie. Återställd från: study.com
- Föll. (s.f.). Historia av kol. Återställd från: tf.uni-kiel.de



Ingen har kommenterat den här artikeln än.