
Omättade kolväteegenskaper och exempel

De omättade kolväten är de som innehåller minst en kol dubbelbindning i sin struktur, som kan innehålla en trippelbindning eftersom mättnaden av en kedja innebär att den har tagit emot alla möjliga väteatomer i varje kol, och det finns inga par fria elektroner där fler väten kan komma in.
Omättade kolväten är indelade i två typer: alkener och alkyner. Alkener är kolväteföreningar som har en eller flera dubbelbindningar i sin molekyl. Under tiden är alkyner kolväteföreningar som har en eller flera trippelbindningar inom sin formel..
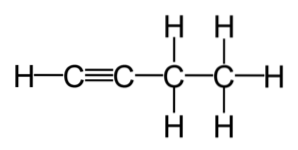
Alkener och alkyner används ofta kommersiellt. Dessa är föreningar med en högre reaktivitetsnivå än mättade kolväten, vilket gör dem till utgångspunkten för många reaktioner, genererade från de vanligaste alkenerna och alkynerna..
Artikelindex
- 1 Nomenklatur
- 1.1 Nomenklatur för alkener
- 1.2 Nomenklatur för alkyner
- 2 fastigheter
- 2.1 Dubbel- och trippelbindningar
- 2.2 cis-trans-isomerisering
- 2.3 Surhet
- 2.4 Polaritet
- 2.5 Kok- och smältpunkter
- 3 Exempel
- 3.1 Etylen (C2H4)
- 3.2 Etin (C2H2)
- 3.3 Propylen (C3H6)
- 3.4 Cyklopenten (C5H8)
- 4 Artiklar av intresse
- 5 Referenser
Nomenklatur
Omättade kolväten heter olika beroende på om de är alkener eller alkyner, med hjälp av suffixen "-eno" och "-ino".
Alkener har minst en kol-kol-dubbelbindning i sin struktur och har den allmänna formeln CnH2n, medan alkyner innehåller minst en trippelbindning och hanteras med formeln CnH2n-2.
Nomenklatur för alkener
För att namnge alkener måste positionerna för kol-kol-dubbelbindningarna anges. Namnen på kemiska föreningar som innehåller C = C-bindningar slutar med suffixet "-eno".
Som med alkaner bestäms basföreningens namn av antalet kolatomer i den längsta kedjan. Till exempel kan molekylen CHtvå= CH-CHtvå-CH3 kommer att kallas "1-buten", men den för H3C-CH = CH-CH3 kommer att kalla sig "2-buten".
Siffrorna som observeras i namnen på dessa föreningar indikerar kolatomen med det minsta antalet i kedjan i vilken alkenens C = C-bindning är belägen..
Antalet kol i denna kedja identifierar prefixet för namnet, liknar alkaner ("met-", "et-", "pro-", "but-", etc.), men använder alltid suffixet "-eno ".
Det måste också specificeras om molekylen är cis eller trans, vilka är typer av geometriska isomerer. Detta tillsätts i namnet, såsom 3-etyl-cis-2-heptan eller 3-etyl-trans-2-heptan.
Nomenklatur för alkyner
För att gissa namnen på kemiska föreningar som innehåller trippel C≡C-bindningar bestäms namnet på föreningen av antalet C-atomer i den längsta kedjan.
På samma sätt som med alkener, anger namnen på alkyner den position i vilken kol-kol-trippelbindningen finns; till exempel i fall av HC2C-CHtvå-CH3, eller "1-butyne" och H3C-C2C-CH3, eller "2-butyne".
Egenskaper
Omättade kolväten består av ett enormt antal olika molekyler, varför de presenterar en serie egenskaper som definierar dem, vilka identifieras nedan:
Dubbel- och trippelbindningar
De dubbla och tredubbla bindningarna av alkener och alkyner har speciella egenskaper som skiljer dem från enkelbindningar: en enkelbindning representerar den svagaste av de tre och bildas av en sigma-bindning mellan två molekyler.
Dubbelbindningen bildas av en sigma-bindning och en pi, och trippelbindningen av en sigma-bindning och två pi. Detta gör alkenerna och alkynerna starkare och kräver mer energi för att bryta ner när reaktioner uppstår..
Vidare är bindningsvinklarna som bildas i en dubbelbindning 120º, medan de för trippelbindningen är 180º. Detta innebär att molekyler med trippelbindningar har en linjär vinkel mellan dessa två kol..
Cis-trans-isomerisering
I alkener och andra föreningar med dubbelbindningar inträffar en geometrisk isomerisering, vilken skiljer sig på sidan av bindningarna i vilka de funktionella grupperna som är bundna till kolerna involverade i denna dubbelbindning finns..
När de funktionella grupperna i en alken är orienterade i samma riktning med avseende på dubbelbindningen kallas denna molekyl cis, men när substituenterna är i olika riktningar kallas den för trans.
Denna isomerisering är inte en enkel skillnad i plats; föreningar kan variera mycket bara för att de är cis-geometri eller trans-geometri.
Cis-föreningar involverar vanligtvis dipol-dipolkrafter (som har ett nettovärde noll i trans); Dessutom har de högre polaritet, kokpunkter och smältpunkter och har högre densitet än deras motsvarigheter. Dessutom är transföreningar mer stabila och frigör mindre förbränningsvärme..
Aciditet
Alkener och alkyner har högre surhet jämfört med alkaner på grund av polariteten hos deras dubbel- och trippelbindningar. De är mindre sura än alkoholer och karboxylsyror; och av de två är alkyner surare än alkener.
Polaritet
Polariteten hos alkener och alkyner är låg, ännu mer i transalkenföreningar, vilket gör dessa föreningar olösliga i vatten..
Ändå löses omättade kolväten lätt i vanliga organiska lösningsmedel såsom etrar, bensen, koltetraklorid och andra föreningar med låg eller ingen polaritet..
Kok- och smältpunkter
På grund av sin låga polaritet är kok- och smältpunkterna för omättade kolväten låga, nästan ekvivalenta med de för alkaner som har samma kolstruktur..
Ändå har alkener lägre kokpunkter och smältpunkter än motsvarande alkaner, vilket kan minska ännu mer om de är cis-isomera, som tidigare nämnts..
Däremot har alkyner högre kok- och smältpunkter än alkaner och motsvarande alkener, även om skillnaden bara är några få grader..
Slutligen har cykloalkener också lägre smälttemperaturer än motsvarande cykloalkaner på grund av dubbelbindningens styvhet..
Exempel
Etylen (CtvåH4)
En kraftfull kemisk förening på grund av dess polymerisation, oxidation och halogeneringskapacitet, bland andra egenskaper.
Ethyne (CtvåHtvå)
Även kallad acetylen är det en brandfarlig gas som används som en användbar källa för belysning och värme..
Propylen (C3H6)
Den näst mest använda föreningen i kemisk industri över hela världen, det är en av produkterna från termolys av petroleum.
Cyklopenten (C5H8)
En förening av cykloalken-typen. Detta ämne används som en monomer för syntes av plast.
Artiklar av intresse
Mättade kolväten eller alkaner.
Referenser
- Chang, R. (2007). Chemistry, nionde upplagan. Mexiko: McGraw-Hill.
- Wikipedia. (s.f.). Alkenes. Hämtad från en.wikipedia.org
- Boudreaux, K. A. (s.f.). Omättade kolväten. Hämtad från angelo.edu
- Tuckerman, M. E. (s.f.). Alkenes och Alkynes. Hämtad från nyu.edu
- University, L. T. (s.f.). De omättade kolvätena: Alkenes och Alkynes. Hämtad från chem.latech.edu



Ingen har kommenterat den här artikeln än.