
Inkretintyper och deras struktur, funktioner, verkningsmekanism
De inkretin är gastrointestinala hormoner som stimulerar utsöndringen av fysiologiska insulinkoncentrationer. Termen används för närvarande för att hänvisa till två olika tarmhormoner, som har olika tekniska namn: GIP eller "glukosberoende insulinotropisk polypeptid" och GLP-1 eller "glukagonliknande peptid 1".
"Incretin" är ett ord och ett begrepp som myntades 1932 av den belgiska fysiologen Jean La Barre, som introducerade det för att definiera tarmhormonfaktorer som kompletterade effekterna av sekretin på den endokrina bukspottkörtelns utsöndring..
Med andra ord använde La Barre termen inkretin för att beteckna alla tarmhormoner som under fysiologiska förhållanden kunde stimulera eller bidra till utsöndringen av bukspottkörtelhormoner såsom insulin, glukagon, bukspottkörtelpolypeptid (PP) och somatostatin..
För närvarande används emellertid termen "inkretin" endast för att beteckna de hormoner som kan stimulera glukosberoende pankreatisk insulinsyntes, specifikt två peptider kända som GIP och GLP-1. Tillkomsten av ny teknik och djupare endokrinologiska studier kan dock avslöja många andra peptider med liknande aktiviteter..
Artikelindex
- 1 Typer av inkretiner och deras struktur
- 2 funktioner
- 3 Handlingsmekanism
- 3.1 GIP: Glukosberoende insulinotropisk polypeptid
- 3.2 GLP-1: glukagonliknande peptid 1
- 4 Referenser
Typer av inkretiner och deras struktur
Traditionellt har endast två inkretiner definierats hos människor: glukosberoende insulinotropisk polypeptid (GIP) och glukagonliknande peptid 1 (GLP-1); de två hormonerna fungerar ytterligare för att stimulera insulinsekretion.
Den första av dessa som isolerades var glukosberoende insulinotropisk polypeptid (GIP). Glukosberoende Insulinotropisk polypeptid). Det är ett peptidhormon med cirka 42 aminosyror och tillhör glukagon-sekretinfamiljen av peptider.

Det andra inkretinet som upptäcktes var glukagonliknande peptid 1 (GLP-1). Glukagonliknande peptid-1), som är en biprodukt av genen som kodar för hormonet "proglukagon"; del av den C-terminala änden av proteinet, för att vara mer exakt.
Funktioner
Inledningsvis definierades inkretiner som faktorer härledda från tarmkanalen som har förmågan att sänka plasmaglukosnivåerna genom stimulering av utsöndringen av bukspottkörtelhormoner såsom insulin och glukagon..
Detta koncept bibehölls med tillkomsten av radioimmunanalyser, där permanent kommunikation mellan tarmen och den endokrina bukspottkörteln bekräftades..
Oral glukosadministrering visade sig vara associerad med signifikanta ökningar av plasmanivåerna, särskilt jämfört med resultat som erhölls med intravenös glukos..
Incretiner anses vara ansvariga för utsöndringen av nästan 70% av plasmainsulin efter oral glukosadministrering, eftersom de är hormoner som utsöndras som svar på näringsintag, vilket ökar utsöndringen av glukosinsulin.
Många ansträngningar görs för närvarande avseende oral eller intravenös administrering av inkretiner till patienter med sjukdomar såsom typ 2-diabetes mellitus eller oral glukosintolerans. Detta beror på att studier har visat, om än preliminärt, att dessa ämnen underlättar en snabb minskning av glykemiska nivåer efter matintag..
Handlingsmekanism
GIP: Glukosberoende insulinotropisk polypeptid
Detta inkretin produceras av K-cellerna i tunntarmen (i tolvfingertarmen och jejunum, specifikt) som svar på intag av fett eller glukos, och är ansvarig för att öka glukosstimulerad insulinsekretion.
Uttrycket av genen som kodar för denna hormonella faktor har demonstrerats hos människor och gnagare både i magen och i tarmen. Studier utförda med detta hormon indikerar att det härrör från en 153 aminosyra "proGIP" -prekursor, som har två signalpeptider vid dess N- och C-terminala ändar, som klyvs för att ge en aktiv peptid med 42 rester..
Halveringstiden för GIP är mindre än 7 minuter när den har syntetiserats och enzymatiskt bearbetats. Denna peptid känns igen av en specifik receptor, GIPR, som är belägen i plasmamembranet i bukspottkörtelns celler, i magen, i tunntarmen, i fettvävnad, i binjurebarken, i hypofysen, i hjärtat, lungorna och andra större organ.
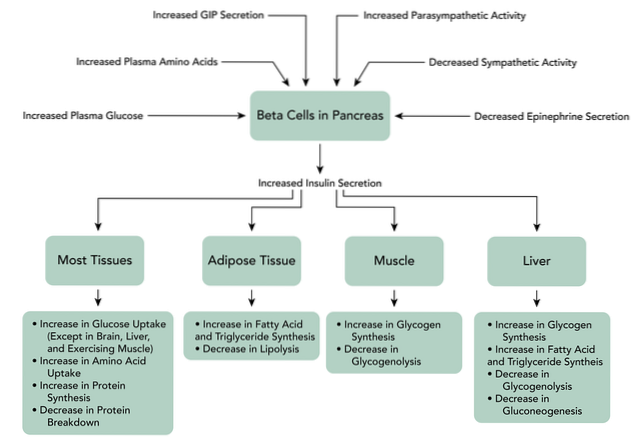
När GIP binder till sina receptorer på betacellerna i bukspottkörteln, utlöser det en ökning av produktionen av cAMP, också hämning av ATP-beroende kaliumkanaler, ökningen av intracellulärt kalcium och slutligen exocytos av insulinlagringsgranulerna..
Dessutom kan denna peptid stimulera gentranskription och insulinbiosyntes, liksom de andra komponenterna i pankreasbetaceller till "folkräkning" av glukos. Även om GIP huvudsakligen fungerar som ett inkretinhormon, utövar det också andra funktioner i andra vävnader såsom centrala nervsystemet, ben, bland andra..
GLP-1: Glukagonliknande peptid 1
Denna peptid produceras från genen som kodar för "proglukagon", så det är en peptid som delar nästan 50% identitet med glukagonsekvensen och kallas därför "glukagonlik" peptid.
GLP-1, en proteolytisk produkt efter translation, är vävnadsspecifik och produceras av tarmens L-celler som svar på matintag. Liksom GIP har detta inkretin förmågan att öka glukosstimulerad insulinsekretion.
Genuttryck och bearbetning
Denna peptid kodas i en av exonerna av proglukagongenen, som uttrycks i alfa-cellerna i bukspottkörteln, i tarmens L-celler (i den distala ileum) och i neuroner i hjärnstammen och hypotalamus..
I bukspottkörteln stimuleras uttrycket av denna gen genom fasta och hypoglykemi (låga koncentrationer av glukos i blodet) och hämmas av insulin. I tarmceller aktiveras genens uttryck för proglukagon genom ökade nivåer av cAMP och matintag.
Produkten som härrör från expressionen av denna gen bearbetas posttranslationellt i de enteroendokrina L-cellerna (i tunntarmen), vilket resulterar inte bara i frisättningen av glukagonliknande peptid 1 utan även i andra något okända faktorer såsom glicentin, oxintomodulin, glukagonliknande peptid 2, etc..
Produktion och action
Intag av livsmedel, särskilt de som är rika på fetter och kolhydrater, stimulerar utsöndringen av GLP-1-peptiden från tarmens enteroendokrina L-celler (nervstimulering eller stimulering medierad av många andra faktorer kan också förekomma).
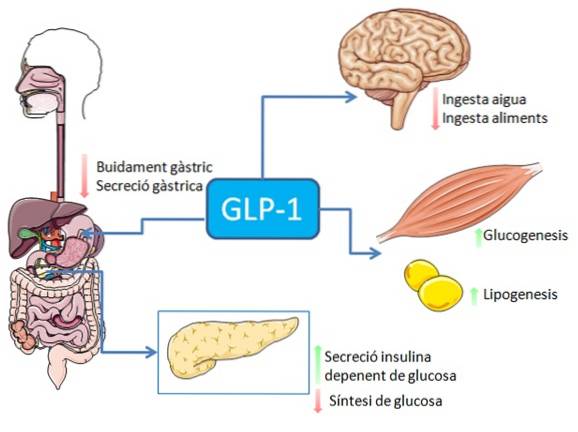
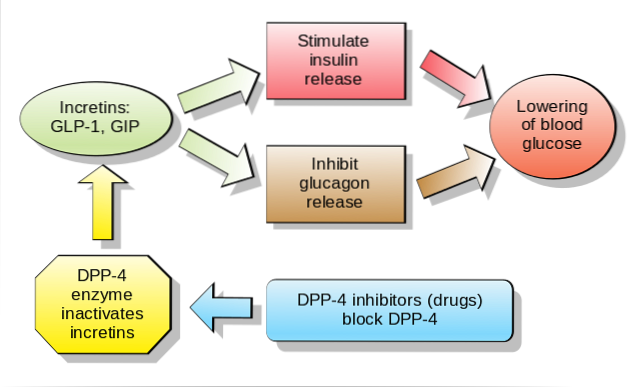
Hos människor och gnagare släpps denna peptid ut i blodomloppet i två faser: 10-15 minuter efter intag och 30-60 minuter senare. Det aktiva livet för detta hormon i blodet är mindre än 2 minuter, eftersom det snabbt inaktiveras proteolytiskt av enzymet dipeptidylpeptidas-4 (DPP-4).
GLP-1 binder till en specifik membranreceptor (GLP-1R) på olika celler i kroppen, inklusive några av de endokrina cellerna i bukspottkörteln, där det stimulerar glukosberoende insulinsekretion.
Hur?
Bindning av GLP-1 till dess receptor på betaceller i bukspottkörteln aktiverar produktionen av cAMP medierad av adenylatcyklas i dessa celler. Det finns en direkt hämning av ATP-beroende kaliumkanaler, som depolariserar cellmembranet.
Därefter ökar intracellulära kalciumnivåer, vilket är resultatet av det GLP-1-beroende inflödet av extracellulärt kalcium genom spänningsberoende kalciumkanaler, aktiveringen av icke-selektiva katjonkanaler och mobilisering av kalciumreserver..
Det ökar också mitokondriell ATP-syntes, vilket gynnar depolarisering. Senare stängs de spänningsstyrda kaliumkanalerna, vilket förhindrar repolarisering av betacellerna och slutligen uppträder exocytos av insulinlagringsgranulerna..
I mag-tarmsystemet har bindningen av GLP-1 till dess receptorer en hämmande effekt på gastrisk syrasekretion och gastrisk tömning, vilket dämpar ökningen av blodsockernivåerna i samband med matintag..
Referenser
- Baggio, L. L. och Drucker, D. J. (2007). Biologi av inkretiner: GLP-1 och GIP. Gastroenterologi, 132 (6), 2131-2157.
- Deacon, C. F., & Ahrén, B. (2011). Fysiologi av inkretiner i hälsa och sjukdom. Granskningen av diabetesstudier: RDS, 8 (3), 293.
- Grossman, S. (2009). Differentiera inkretinterapier baserat på strukturaktivitet och metabolism: Fokus på liraglutid. Farmakoterapi: Journal of Human Pharmacology and Drug Therapy, 29 (12P2), 25S-32S.
- Kim, W., & Egan, J. M. (2008). Inkretins roll i glukosehomeostas och diabetesbehandling. Farmakologiska recensioner, 60 (4), 470-512.
- Nauck, M. A., & Meier, J. J. (2018). Inkretinhormoner: deras roll i hälsa och sjukdom. Diabetes, fetma och ämnesomsättning, 20, 5-21.
- Rehfeld, J. F. (2018). Ursprunget och förståelsen för inkretinkonceptet. Gränser inom endokrinologi, 9.
- Vilsbøll, T., & Holst, J. J. (2004). Inkretiner, insulinsekretion och typ 2-diabetes mellitus. Diabetologia, 47 (3), 357-366



Ingen har kommenterat den här artikeln än.