
Avogadros lagmätningsenheter och experiment
De Avogadros lag postulerar att en lika stor volym av alla gaser, vid samma temperatur och tryck, har samma antal molekyler. Amadeo Avogadro, en italiensk fysiker, föreslog två hypoteser 1811: den första säger att atomerna i elementära gaser är tillsammans i molekyler istället för att existera som separata atomer, som John Dalton sa..
Den andra hypotesen säger att lika stora gasvolymer vid konstant tryck och temperatur har samma antal molekyler. Avogadros hypotes om antalet molekyler i gaser accepterades inte förrän 1858, då den italienska kemisten Stanislao Cannizaro byggde ett logiskt kemisystem baserat på detta.

Följande kan härledas från Avogadros lag: för en given massa av en idealgas är dess volym och antalet molekyler direkt proportionella om temperaturen och trycket är konstanta. Detta innebär också att molvolymen av gaser som beter sig idealt är densamma för alla.
Till exempel, givet ett antal ballonger, märkta A till Z, fylls de alla tills de blåses upp till en volym av 5 liter. Varje bokstav motsvarar en annan gasform; det vill säga dess molekyler har sina egna egenskaper. Avogadros lag säger att alla ballonger rymmer samma antal molekyler.
Om ballongerna nu blåses upp till 10 liter, enligt Avogadros hypoteser, kommer dubbelt så många initiala gasformiga molar att ha införts.
Artikelindex
- 1 Vad den består av och måttenheter
- 1.1 Avdrag av värdet på R när det uttrycks i L atm / K mol
- 2 Vanlig form av Avogadros lag
- 3 Konsekvenser och konsekvenser
- 4 ursprung
- 4.1 Avogadros hypotes
- 4.2 Avogadros nummer
- 5 Avogadros experiment
- 5.1 Experiment med kommersiella behållare
- 6 Exempel
- 6.1 O2 + 2H2 => 2H2O
- 6,2 N2 + 3H2 => 2NH3
- 6,3 N2 + O2 => 2NO
- 7 Referenser
Vad den består av och måttenheter
Avogadros lag säger att, för en massa av en idealgas, är gasens volym och antalet moler direkt proportionella om temperaturen och trycket är konstanta. Matematiskt kan det uttryckas med följande ekvation:
V / n = K
V = gasens volym, vanligtvis uttryckt i liter.
n = mängden av ämnet uppmätt i mol.
Från den så kallade idealgaslagen har vi också följande:
PV = nRT
P = gastryck uttrycks vanligtvis i atmosfärer (atm), i mm kvicksilver (mmHg) eller i Pascal (Pa).
V = gasens volym uttryckt i liter (L).
n = antal mol.
T = gasens temperatur uttryckt i grader Celsius, grader Fahrenheit eller grader Kelvin (0 ºC är lika med 273,15 K).
R = den universella konstanten av idealgaser, som kan uttryckas i olika enheter, bland vilka följande sticker ut: 0,08205 L atm / K. mol (L atm K-1.mol-1); 8,314 J / K. mol (J.K-1.mol-1) (J är joule); och 1 987 cal / Kmol (cal.K-1.mol-1) (kal är kalorier).
Avdrag för värdet på R uttryckt i LATM / KMol
Volymen som en mol av en gas upptar vid en atmosfär av tryck och 0 ºC motsvarande 273K är 22,414 liter.
R = PV / T
R = 1 atm x 22,414 (L / mol) / (273 ºK)
R = 0,082 L atm / mol.K
Den ideala gasekvationen (PV = nRT) kan skrivas enligt följande:
V / n = RT / P
Om temperatur och tryck antas vara konstanta, eftersom R är en konstant, då:
RT / P = K
Senare:
V / n = K
Detta är en konsekvens av Avogadros lag: förekomsten av ett konstant förhållande mellan volymen som en idealgas upptar och antalet mol av den gasen, för en konstant temperatur och ett tryck..
Vanlig form av Avogadros lag
Om du har två gaser blir ekvationen ovan följande:
V1/ n1= Vtvå/ ntvå
Detta uttryck är också skrivet som:
V1/ Vtvå= n1/ ntvå
Ovanstående visar det angivna proportionalitetsförhållandet.
I sin hypotes påpekade Avogadro att två idealgaser i samma volym och vid samma temperatur och tryck innehåller samma antal molekyler.
I förlängning gäller detsamma för riktiga gaser; till exempel en lika stor volym Otvå och ntvå innehåller samma antal molekyler när det har samma temperatur och tryck.
Verkliga gaser visar små avvikelser från idealbeteende. Avogadros lag gäller emellertid ungefär för riktiga gaser vid tillräckligt lågt tryck och vid höga temperaturer.
Konsekvenser och konsekvenser
Den viktigaste konsekvensen av Avogadros lag är att den konstanta R för ideala gaser har samma värde för alla gaser.
R = PV / nT
Så om R är konstant för två gaser:
P1V1/ nT1= PtvåVtvå/ ntvåTtvå = konstant
Suffix 1 och 2 representerar två olika idealgaser. Slutsatsen är att den ideala gaskonstanten för 1 mol gas är oberoende av gasens natur. Då kommer volymen som upptas av denna mängd gas vid en given temperatur och ett tryck alltid att vara densamma.
En konsekvens av tillämpningen av Avogadros lag är upptäckten att 1 mol av en gas upptar en volym på 22.414 liter vid ett tryck av 1 atmosfär och vid en temperatur av 0 ºC (273K).
En annan uppenbar konsekvens är följande: om tryck och temperatur är konstanta, när mängden gas ökas, ökar dess volym också..
ursprung
1811 lade Avogadro fram sin hypotes baserad på Daltons atomteori och Gay-Lussacs lag om molekylers rörelsevektorer..
Gay-Lussac drog slutsatsen 1809 att "gaser, oavsett proportioner de kan kombineras, ger alltid upphov till föreningar vars element uppmätta i volym alltid är multiplar av en annan".
Samma författare visade också att "gaskombinationer alltid sker enligt mycket enkla volymförhållanden".
Avogadro påpekade att kemiska reaktioner i gasfasen involverar molekylära arter av både reaktanter och produkt.
Enligt detta uttalande måste förhållandet mellan reaktanten och produktmolekylerna vara ett heltal, eftersom förekomsten av bindningsbrott före reaktionen (enskilda atomer) inte är sannolikt. Molmängder kan emellertid uttryckas med bråkvärden.
För sin del indikerar lagen om kombinationsvolymer att det numeriska förhållandet mellan gasvolymerna också är enkelt och helt. Detta resulterar i en direkt koppling mellan volymerna och antalet molekyler i gasformiga arter..
Avogadro-hypotes
Avogadro föreslog att gasmolekyler var diatomiska. Detta förklarade hur två volymer molekylärt väte kombineras med en volym molekylärt syre för att ge två volymer vatten..
Vidare föreslog Avogadro att om lika stora gasvolymer innehöll samma antal partiklar, skulle förhållandet mellan gasernas densitet vara lika med förhållandet mellan molekylmassorna för dessa partiklar..
Att uppdela d1 med d2 ger uppenbarligen kvoten m1 / m2, eftersom volymen upptagen av de gasformiga massorna är densamma för båda arterna och den avbryts:
d1 / d2 = (m1 / V) / (m2 / V)
d1 / d2 = m1 / m2
Avogadros nummer
En mol innehåller 6,022 x 102. 3 molekyler eller atomer. Denna siffra kallas Avogadros nummer, även om han inte var den som beräknade den. Jean Pierre, nobelprisvinnare från 1926, gjorde motsvarande mått och föreslog namnet till ära för Avogadro.
Avogadros experiment
En mycket enkel demonstration av Avogadros lag består i att placera ättiksyra i en glasflaska och sedan tillsätta natriumbikarbonat, stänga flaskans mynning med en ballong som förhindrar att en gas kommer in eller ut ur flaskan.
Ättiksyra reagerar med natriumbikarbonat och frigör därmed COtvå. Gasen ackumuleras i ballongen och orsakar dess inflation. Teoretiskt sett är volymen som nås av ballongen proportionell mot antalet CO-molekylertvå, enligt Avogadros lag.
Detta experiment har dock en begränsning: ballongen är en elastisk kropp; därför, eftersom dess vägg sträcker sig på grund av ackumulering av COtvå, en kraft genereras i detta som motsätter sig dess distans och försöker minska ballongens volym.
Experimentera med kommersiella containrar
Ett annat illustrativt experiment med Avogadros lag presenteras med användning av läskburkar och plastflaskor..
När det gäller läskburkar hälls bakpulver i den och sedan tillsätts en citronsyralösning. Föreningarna reagerar med varandra och producerar frisättning av CO-gastvå, som ackumuleras inuti burken.
Därefter tillsätts en koncentrerad natriumhydroxidlösning, som har funktionen att "sekvestrera" CO.två. Tillgången till burken stängs sedan snabbt med hjälp av maskeringstejp.
Efter en viss tid observeras att burken dras samman, vilket indikerar att CO har minskat.två. Sedan kan man tro att det finns en minskning i burkens volym som motsvarar en minskning av antalet CO-molekyler.två, enligt Avogadros lag.
I experimentet med flaskan följs samma procedur som med läskburken, och när NaOH tillsätts stängs flaskans mun med locket; likaså observeras en sammandragning av flaskans vägg. Som ett resultat kan samma analys utföras som i fallet med läskburken..
Exempel
De tre bilderna nedan illustrerar konceptet i Avogadros lag, som avser volymen som gaser upptar och antalet molekyler av reaktanter och produkter..
ELLERtvå + 2Htvå => 2HtvåELLER
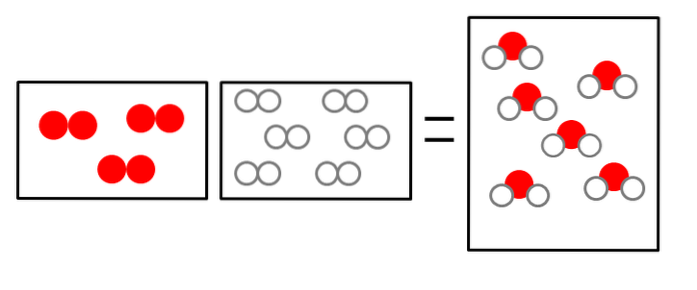
Volymen vätgas är dubbel, men den upptar en behållare av samma storlek som gasformigt syre.
Ntvå + 3Htvå => 2NH3
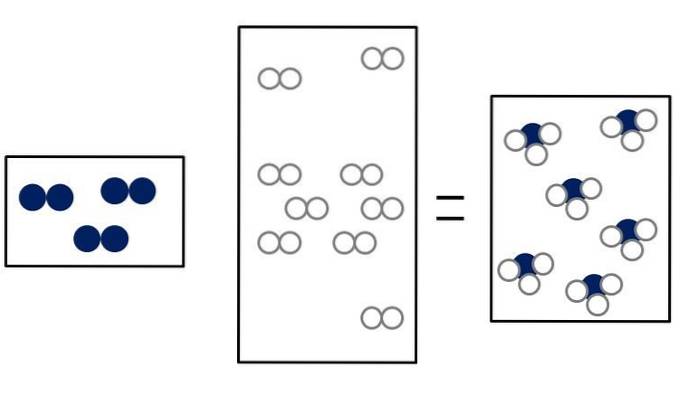
Ntvå + ELLERtvå => 2NO

Referenser
- Bernard Fernandez, doktor. (Februari 2009). Två hypoteser av Avogadro (1811). [PDF]. Hämtad från: bibnum.education.fr
- Nuria Martínez Medina. (5 juli 2012). Avogadro, den stora italienska forskaren på 1800-talet. Hämtad från: rtve.es
- Muñoz R. och Bertomeu Sánchez J.R. (2003) Vetenskapens historia i läroböcker: Avogadros hypotes (er), Undervisningsvetenskap, 21 (1), 147-161.
- Helmenstine, Anne Marie, Ph.D. (1 februari 2018). Vad är Avogadros lag? Hämtad från: thoughtco.com
- Redaktörerna för Encyclopaedia Britannica. (2016, 26 oktober). Avogadros lag. Encyclopædia Britannica. Hämtad från: britannica.com
- Yang, S. P. (2002). Hushållsprodukter som används för att kollapsa stänger containrar och visar Avogadros lag. Kemisk pedagog. Vol: 7, sidor: 37-39.
- Glasstone, S. (1968). Fysisk kemifördrag. tvåger Ed. Ledare Aguilar.

Ingen har kommenterat den här artikeln än.