
Kloroxid (V) egenskaper, struktur, användningsområden
De kloroxid (V) är en mycket instabil oorganisk förening vars kemiska formel är CltvåELLER5. Det är en av de många kloroxiderna, som kännetecknas av att de är molekylära eller till och med radikala arter.
CltvåELLER5 Det har bara hittat liv i pappers- och teoretiska beräkningar; dock har dess existens inte uteslutits och det är troligt att vissa kan karakteriseras (med avancerade spektroskopitekniker). Vad som kan förutsägas från allmänna kemikoncept för denna oxid är att det är anhydrid av klorsyra, HClO3.
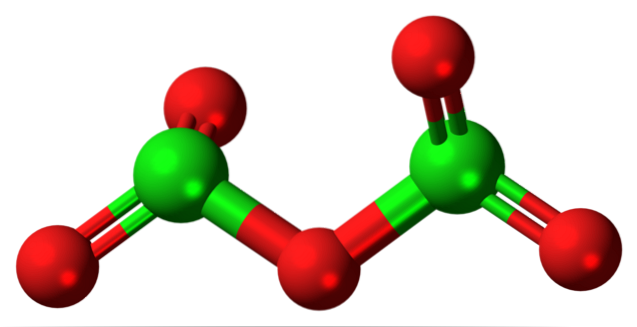
Den hypotetiska klor (V) oxidmolekylen visas ovan. Observera att eftersom det är en molekyl, beaktas inte närvaron av Cl-jon alls+5; ännu mindre när den måste ha en sådan polariserande kraft för att tvinga syre att binda kovalent.
Liksom alla instabila föreningar frigör den energi för att bryta ner till mer stabila produkter; process som i många fall är explosiv. När CltvåELLER5 sönderdelar frigör ClOtvå migtvå. Det teoretiseras att i vatten, beroende på isomeren av CltvåELLER5, kan bilda olika kloroxosyror.
Artikelindex
- 1 Fastigheter
- 2 Struktur av kloroxid (V)
- 2.1 Molekyl
- 2.2 Lewis-struktur
- 2.3 Isomerer och deras respektive hydrolys
- 3 Nomenklatur
- 4 användningsområden
- 5 Referenser
Egenskaper
Molmassan av CltvåELLER5 den är 150,9030 g / mol. Från denna massa och dess hypotetiska molekyl kan man anta att om den kunde isoleras, skulle den troligen vara en oljig vätska; naturligtvis att jämföra det med det fysiska utseendet på CltvåELLER7.
Även om den inte kan isoleras eller karakteriseras, är denna kloroxid sur, kovalent och måste också ha ett litet dipolmoment. Dess surhet är förståelig om den kemiska ekvationen av hydrolysen analyseras:
CltvåELLER5 + HtvåO2HClO3
Att vara HClO3 klorsyra. Den omvända reaktionen skulle resultera i att syran kan torkas ut:
2HClO3 => CltvåELLER5 + HtvåELLER
Å andra sidan när CltvåELLER5 knappt producerad, sönderdelas den:
2CltvåELLER5 => 4ClOtvå + ELLERtvå
Det är därför en mellanliggande art snarare än en oxid korrekt. Dess nedbrytning måste vara så snabb (med tanke på att även CltvåELLER5), som inte har upptäckts med nuvarande instrumental analysmetoder.
Struktur av kloroxid (V)
Molekyl
I den övre bilden visades strukturen för den hypotetiska Cl-molekylen.tvåELLER5 med en modell av kulor och stänger. De röda sfärerna representerar syreatomer och de gröna sfärerna representerar kloratomer. Varje klor har en trigonal pyramidmiljö, så dess hybridisering måste vara sp3.
Molekylen av CltvåELLER5 det kan ses som två trigonala pyramider kopplade av ett syre. Men om du tittar noga orienterar en pyramid sina syreatomer nedåt, den andra ut ur planet (mot läsaren)..
Därför antas det att det finns rotationer i O-länkentvåCl-O-ClOtvå, vilket gör molekylen relativt dynamisk. Observera att formeln OtvåCHLOClOtvå är ett sätt att representera CltvåELLER5.
Lewis-struktur
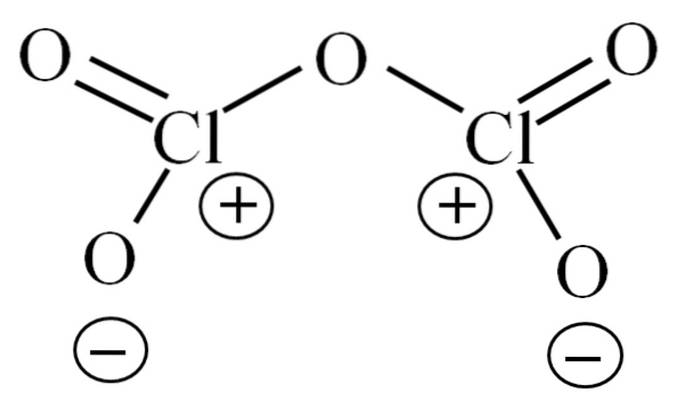
Hittills har molekylen i sig inte gjort det möjligt att dechiffrera vad dess instabilitet beror på. För att belysa denna fråga vänder vi oss till dess Lewis-struktur, som visas ovan. Observera att strukturen felaktigt kan anses vara plan, men i föregående underavsnitt klargjordes att så inte är fallet..
Varför har båda kloratomerna positiva formella laddningar? Eftersom klor har ett ledigt par elektroner kvar, vilket kan verifieras genom att tillämpa Valencia Bond Theory (vilket inte kommer att göras här för att förenkla). Således är dess formella belastning:
CF = 7 - (4 + 2) = 1
Och vad har detta att göra med deras instabilitet? Tja, klor är avsevärt elektronegativ och därför en dålig bärare av positiva formella laddningar. Detta återgår till CltvåELLER5 en mycket sur art, eftersom den måste skaffa elektroner för att tillgodose den elektroniska efterfrågan på de två klorerna.
Motsatsen händer med BrtvåELLER5 och jagtvåELLER5, oxider som existerar under normala förhållanden. Detta beror på att både brom och jod är mindre elektronegativa än klor; och därför stöder de bättre den positiva formella avgiften.
Isomerer och deras respektive hydrolys
Hittills har hela förklaringen fallit på en av de två isomererna av CltvåELLER5: OtvåCHLOClOtvå. Vilken är den andra? O3CHLOClO. I denna isomer saknar klorerna formella positiva laddningar och bör därför vara en mer stabil molekyl. Men båda OtvåCHLOClOtvå som O3ClOClO bör genomgå hydrolysreaktioner:
ELLERtvåCl-O-ClOtvå + HtvåO => 2OtvåCl-OH (som inte är mer än HClO3)
ELLER3Cl-O-ClO + HtvåO => O3Cl-OH (HClO4) + HO-ClO (HClOtvå)
Observera att upp till tre kloroxosyror kan bildas: HClO3, HClO4 och HClOtvå
Nomenklatur
Dess namn "kloroxid (V)" motsvarar det som tilldelats enligt lagernomenklaturen. CltvåELLER5 Det kan också ha två andra namn: dikloropentaoxid och kloranhydrid, tilldelade av de systematiska respektive traditionella nomenklaturerna..
Applikationer
Mer än motiverande beräkningsstudier, CltvåELLER5 Den kommer inte att användas förrän den upptäcks, isoleras, karaktäriseras, lagras och visas att den inte exploderar vid minsta kontakt..
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Sandra Luján Quiroga och Luis José Perissinotti. (2011). Kloroxosyror och struktur av dikloroxider. Chem. Educator, Vol. 16.
- Kemisk formulering. (2019). Kloroxid (V). Återställd från: formulacionquimica.com
- Linus Pauling. (1988). Allmän kemi. Dover Publications, INC., New York.
- Richard C. Ropp. (2013). Encyclopedia of the Alkaline Earth Compounds. Elsevier.


Ingen har kommenterat den här artikeln än.