
Järnmetallstruktur, typer, egenskaper

De järnmetall De är de som innehåller järn (Fe), liksom små mängder andra metaller som tillsätts för att ge vissa fördelaktiga egenskaper till deras legeringar. Även om järn kan finnas i olika oxidationstillstånd är +2 (järn) och +3 (järn) de vanligaste.
Uttrycket "järn" avser emellertid närvaron av järn oavsett dess oxidationstillstånd i materialet. Järn är det fjärde mest förekommande elementet i jordskorpan, men globalt är det det viktigaste jordelementet. Därför har järnmetaller historiskt och industriellt haft en roll i människans utveckling..

Detta har varit fallet på grund av dess stora överflöd och modifierbara egenskaper. Dessa järnmetaller börjar från utvinning av järn från mineralogiska källor, såsom: hematit (FetvåELLER3), magnetit (Fe3ELLER4) och siderit (FeCO3). På grund av prestanda är dessa oxider mest önskvärda vid järnbearbetning.
Den översta bilden visar ett glödande gjutjärns “tunga av eld”. Av alla järnmetaller består det viktigaste av en järnlegering med små mängder kol tillsatt: stål..
Artikelindex
- 1 Struktur
- 2 Egenskaper och egenskaper
- 3 Exempel
- 3.1 Smidesjärn eller smidesjärn
- 3.2 Råjärn eller råjärn
- 3.3 Rent järn
- 3.4 Gjut- eller gjutjärn (gjuterier)
- 3.5 Grått järn
- 3.6 Segjärn
- 3.7 Stål
- 4 Stål och dess tillämpningar
- 4.1 Kol eller konstruktionsstål
- 4.2 Kiselstål
- 4.3 Galvaniserat stål
- 4.4 Rostfritt stål
- 4.5 Manganstål
- 4.6 Invar stål
- 5 Referenser
Strukturera
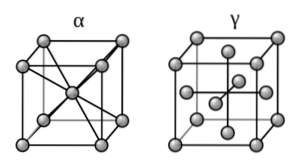
Eftersom järn är huvudkomponenten i järnmetaller består deras strukturer av kristallina deformationer av deras rena fasta ämnen.
Följaktligen är järnlegeringar som stål inget annat än interstitiell inkludering av andra atomer i kristallarrangemanget av järn..
Vad är detta arrangemang? Järn bildar allotroper (olika fasta strukturer) beroende på temperaturen det utsätts för, och förändrar dess magnetiska egenskaper. Således presenterar den vid rumstemperatur ett bcc-arrangemang, även känt som alfajärn (kuben till vänster, övre bild).
Å andra sidan, i ett område med höga temperaturer (912-1394 (ºC)), manifesterar det arrangemanget ccp eller fcc: järn-gamma (kuben till höger). När denna temperatur har överskridits återgår strykjärnet till bcc-formen för att slutligen smälta.
Denna förändring i alfa-gammastruktur kallas fasomvandling. Gamma-fasen kan "fånga" kolatomer, medan alfafasen inte är det.
Således, när det gäller stål, kan dess struktur visualiseras som uppsättningar av järnatomer som omger en kolatom..
På detta sätt beror strukturen hos järnmetaller på fördelningen av järnfaserna och atomerna hos andra arter i det fasta ämnet..
Egenskaper och egenskaper
Rent järn är en mjuk och mycket duktil metall, mycket känslig för korrosion och oxidation från yttre faktorer. Men när den innehåller olika proportioner av annan metall eller kol, förvärvar den nya egenskaper och egenskaper..
I själva verket är det dessa förändringar som gör järnmetaller användbara för otaliga applikationer..
Järnlegeringar är i allmänhet starka, slitstarka och tuffa, med ljusgrå färger och magnetiska egenskaper..
Exempel
Smidesjärn eller sött
Den har en kolhalt mindre än 0,03%. Den är silverfärgad, rostar lätt och spricker internt. Dessutom är det segt och formbart, en bra ledare för elektricitet och svår att svetsa..
Det är den typ av järnmetall som människan först använde vid tillverkning av vapen, redskap och byggnader. Den används för närvarande i tallrikar, nitar, spaljéer etc. Eftersom det är en bra elektrisk ledare används den i kärnan av elektromagneter.
Grovjärn eller gjutjärn
I den ursprungliga masugnsprodukten innehåller den 3-4% kol och spår av andra element som kisel, magnesium och fosfor. Dess huvudsakliga användning är att ingripa i produktionen av andra järnmetaller.
Rent järn
Det är en gråvit metall med magnetiska egenskaper. Trots sin hårdhet är den spröd och spröd. Dess smältpunkt är hög (1500 ºC.) Och den oxiderar snabbt.
Det är en bra elektrisk ledare, varför den används i elektriska och elektroniska komponenter. Annars är det till liten nytta.
Gjutjärn eller gjutjärn (gjuterier)
De har en hög kolhalt (mellan 1,76% och 6,67%). De är hårdare än stål men mer spröda. De smälter vid en lägre temperatur än rent järn, cirka 1100 ºC.
Eftersom den är formbar är det möjligt att tillverka delar av olika storlekar och komplexitet med den. I denna typ av järn används grå typ gjutjärn, vilket ger stabilitet och formbarhet..
De har högre korrosionsbeständighet än stål. De är också billiga och täta. De uppvisar flytbarhet vid relativt låga temperaturer och kan fylla formarna.
De har också bra kompressionsegenskaper, men är spröda och går sönder innan de böjs, så de är inte lämpliga för mycket detaljerade bitar..
Grått järn
Det är det vanligaste gjutjärnet, dess grå nyans beror på förekomsten av grafit. Den har en kolkoncentration mellan 2,5% och 4%; dessutom innehåller den 1-3% silikon för att stabilisera grafiten.
Den har många av attributen hos grundläggande gjutjärn, eftersom de är mycket flytande. Den är oflexibel och böjer sig strax innan den går sönder.
Ductil järn
Kol tillsätts i form av sfärisk granit i en koncentration mellan 3,2% och 3,6%. Den sfäriska formen av grafit ger större slaghållfasthet och smidighet än gråjärn, vilket gör att den kan användas i detaljerade och kantade mönster.
Stål
Kolinnehåll mellan 0,03% och 1,76%. Bland dess egenskaper är hårdhet, uthållighet och motstånd mot fysiska ansträngningar. I allmänhet rostar de lätt. De är svetsbara och kan bearbetas i smide eller mekaniskt.
De har också större hårdhet och mindre flytbarhet än gjutjärn. Av denna anledning behöver de höga temperaturer för att flöda i formarna..
Stål och dess tillämpningar

Det finns flera typer av stål, alla med olika tillämpningar:
Kol eller konstruktionsstål
Kolkoncentrationen kan variera och bildar fyra former: mjukt stål (0,25% kol), halvsött stål (0,35% kol), halvhårt stål (0,45% kol) och hårt (0,5%).
Den används vid tillverkning av verktyg, stålplåt, järnvägsfordon, spikar, skruvar, bilar och båtar.
Kiselstål
Även kallat elstål eller magnetiskt stål. Dess kiselkoncentration varierar mellan 1% och 5%, Fe varierar mellan 95% och 99%, och kol har 0,5%.
Dessutom tillsätts mindre mängder mangan och aluminium. Den har stor hårdhet och hög elektrisk motståndskraft. Den används vid tillverkning av magneter och elektriska transformatorer.
Galvaniserat stål
Den är belagd med en zinkbeläggning som skyddar den mot rost och korrosion. Därför är det användbart för att tillverka rördelar och verktyg..
Rostfritt stål
Den har en sammansättning av Cr (14-18%), Ni (7-9%), Fe (73-79%) och C (0,2%). Det är resistent mot oxidation och korrosion. Det används vid produktion av bestick såväl som skärmaterial.
Manganstål
Dess sammansättning är Mn (10-18%), Fe (82-90%) och C (1,12%). Det är hårt och slitstarkt. Används på tågskenor, kassaskåp och rustning.
Invar stål
Den har 36% Ni, 64% Fe och 0,5% kol. Den har en låg expansionskoefficient. Den används vid konstruktionen av indikatorvågar; till exempel: måttband.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. 8: e upplagan, CENGAGE Learning.
- Administration. (19 september 2017). Vad är järn, var kommer det ifrån och hur många typer av järn finns det. Hämtad den 22 april 2018 från: termiser.com
- Wikipedia. (2018). Järn. Hämtad den 22 april 2018 från: en.wikipedia.org
- Metaller. Generella egenskaper. Extraktion och klassificering av metaller. Hämtad den 22 april 2018 från: edu.xunta.gal
- Jose Ferrer. (Januari 2018). Metallurgisk karakterisering av järnhaltiga och icke-järnhaltiga material. Hämtad den 22 april 2018 från: steemit.com
- Uppsatser, Storbritannien. (November 2013). Grundläggande strukturer för järnmetaller. Hämtad den 22 april 2018 från: ukessays.com
- Cdang. (7 juli 2011). Iron Alpha & Iron Gamma. [Figur]. Hämtad den 22 april 2018 från: commons.wikimedia.org
- Włodi. (15 juni 2008). Flätor i rostfritt stål. [Figur]. Hämtad den 22 april 2018 från: commons.wikimedia.org



Ingen har kommenterat den här artikeln än.