
Karaktäristiska myofibriller, struktur, komposition, funktioner

De myofibriller De är de strukturella enheterna i muskelceller, även kända som muskelfibrer. De är mycket rikliga, är ordnade parallellt och är inbäddade av cytosolen i dessa celler.
Strierade muskelceller eller fibrer är mycket långa celler, upp till 15 cm långa och från 10 till 100 μm i diameter. Dess plasmamembran är känt som sarcolemma och dess cytosol som sarkoplasma..
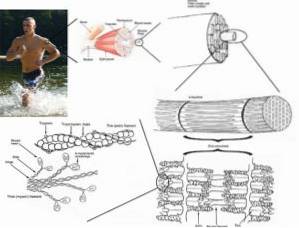
Inom dessa celler finns, förutom myofibrillerna, flera kärnor och mitokondrier som är kända som sarkosomer, såväl som en framträdande endoplasmatisk retikulum som kallas sarkoplasmatisk retikulum..
Myofibriller känns igen som de "kontraktila elementen" i muskler hos ryggradsdjur. De består av flera typer av proteiner som ger dem de elastiska och infällbara egenskaperna. Dessutom upptar de en viktig del av muskelfibrernas sarkoplasma.
Artikelindex
- 1 Skillnader mellan muskelfibrer
- 2 Allmänna egenskaper
- 2.1 Bildning av myofibriller eller "myofibrillogenes"
- 3 Struktur och sammansättning
- 3.1 - Tunna myofilament
- 3.2 - Tjocka myofilament
- 3.3 - Associerade proteiner
- 4 funktioner
- 5 Referenser
Skillnader mellan muskelfibrer
Det finns två typer av muskelfibrer: strimmiga och släta fibrer, var och en med en anatomisk fördelning och en specifik funktion. Myofibriller är särskilt viktiga och tydliga i de strimmiga muskelfibrerna som utgör skelettmuskulaturen..
Striated fibrer presenterar ett repetitivt mönster av tvärgående band när de observeras under ett mikroskop och är associerade med skelettmuskler och en del av hjärtmusklerna..
Släta fibrer, å andra sidan, presenterar inte samma mönster under mikroskopet och finns i de karakteristiska musklerna i kärl- och matsmältningssystemet (och alla inälvor).
Generella egenskaper
Myofibriller består av två typer av sammandragna trådar (även kända som myofilament), som i sin tur består av de trådiga proteinerna myosin och aktin, som kommer att beskrivas senare..
Olika forskare har bestämt att halveringstiden för myofibrillernas kontraktila proteiner sträcker sig från 5 dagar till 2 veckor, så att muskeln är en mycket dynamisk vävnad, inte bara ur kontraktil synvinkel utan också från syntes och förnyelse syn på dess strukturella element.
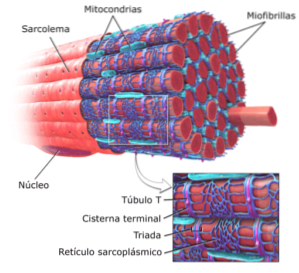
Den funktionella enheten för varje myofibril i muskelceller eller fibrer kallas en sarcomer och avgränsas av en region som kallas "Z-bandet eller linjen", varifrån aktin-myofilamenten sträcker sig.
Eftersom myofibriller upptar en väsentlig del av sarkoplasman begränsar dessa fibrösa strukturer placeringen av kärnorna i cellerna till vilka de tillhör mot cellernas periferi, nära sarkolemma..
Vissa mänskliga patologier är relaterade till förskjutningen av kärnorna i myofibrillära buntar, och dessa är kända som centro-nukleära myopatier.
Bildning av myofibriller eller "myofibrillogenes"
De första myofibrillerna monteras under utvecklingen av embryonala skelettmuskler.
Proteinerna som utgör sarkomerer (de funktionella enheterna av myofibriller) inriktas initialt från ändarna och sidorna av "premiofibriller" som består av aktinfilament och små delar av icke-muskulärt myosin II och specifikt a-aktin av muskler..
När detta inträffar uttrycks generna som kodar hjärt- och skelettisoformerna av a-aktin i olika proportioner i muskelfibrer. Först är mängden hjärt-isoform som uttrycks större och sedan förändras detta mot skelettet.
Efter bildandet av premiofibrillerna samlas de framväxande myofibrillerna bakom zonen för premiofibrilbildning och i dessa detekteras muskel-myosin II-formen..
Vid denna tidpunkt ligger myosinfilamenten i linje och komplex med andra specifika myosinbindande proteiner, vilket också förekommer med aktinfilament..
Struktur och sammansättning
Som diskuterades för ett ögonblick sedan består myofibriller av sammandragna proteinmyofilament: aktin respektive myosin, som också är kända som tunna respektive tjocka myofilament. Dessa är synliga under ljusmikroskopet.
- Tunna myofilament
De tunna filamenten i myofibrillerna består av proteinaktinet i dess trådform (aktin F), som är en polymer med den globulära formen (aktin G), som har en mindre storlek.
De trådiga trådarna av G-aktin (F-aktin) bildar en dubbel tråd som rullar in i en spiral. Var och en av dessa monomerer väger mer eller mindre 40 kDa och kan binda myosin vid specifika ställen..
Dessa trådar är ca 7 nm i diameter och sträcker sig mellan två områden som är kända som band I och band A. I band A är dessa trådar placerade runt de tjocka trådarna som bildar ett sekundärt sexkantigt arrangemang..
Specifikt är varje tunt glödtråd symmetriskt separerat från tre tjocka glödtrådar, och varje tjockt glödtråd är omgivet av sex tunna trådar.
Tunna och tjocka trådar interagerar med varandra genom "tvärbryggor" som skjuter ut från de tjocka filamenten och dyker upp i myofibrilstrukturen med regelbundna avstånd mellan 14 nm..
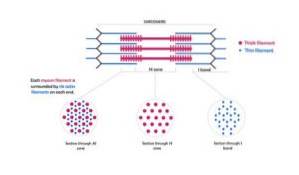
Aktinfilamenten och andra associerade proteiner sträcker sig bortom "kanterna" på Z-linjerna och överlappar myosinfilamenten mot mitten av varje sarkomer..
- Tjocka myofilament
De tjocka filamenten är polymerer av myosin II-proteinet (vardera 510 kDa) och avgränsas av regioner kända som "A-band".
Myosin myofilament är ungefär 16 nm långa och är ordnade i sexkantiga arrangemang (om ett tvärsnitt av en myofibril observeras).
Varje myosin II-filament består av många packade myosinmolekyler, var och en består av två polypeptidkedjor som har en klubbformad region eller "huvud" och som är ordnade i "buntar" för att bilda filamenten..
Båda buntarna hålls tvärs över ändarna i mitten av varje sarkomer, så att "huvuden" på varje myosin riktas mot Z-linjen, där de tunna filamenten är fästa..
Myosinhuvudena uppfyller mycket viktiga funktioner, eftersom de har bindningsställen för ATP-molekyler och dessutom under muskelsammandragning kan de bilda tvärbryggor för att interagera med de tunna aktinfilamenten.
- Associerade proteiner
Aktinfilament är "förankrade" eller "fixerade" på plasmamembranet i muskelfibrer (sarcolemma) tack vare deras interaktion med ett annat protein som kallas dystrofin.
Dessutom finns det två viktiga aktinbindande proteiner som kallas troponin och tropomyosin som tillsammans med aktinfilament bildar ett proteinkomplex. Båda proteinerna är väsentliga för regleringen av interaktioner som äger rum mellan tunna och tjocka filament..
Tropomyosin är också en tvåsträngad trådformig molekyl som associeras med aktinhelices specifikt i området för spåren mellan de två trådarna. Troponin är ett tredelat globulärt proteinkomplex som är ordnat i intervaller på aktinfilamenten.
Det sista komplexet fungerar som en kalciumberoende ”switch” som reglerar muskelfibrernas sammandragningsprocesser, varför det är av yttersta vikt..
I den räfflade muskeln hos ryggradsdjur finns det dessutom två andra proteiner som interagerar med de tjocka och tunna filamenten, så kallade titin respektive nebulin..
Nebulin har viktiga funktioner för att reglera längden på aktinfilament, medan titin deltar i stöd och förankring av myosinfilament i en region av sarkomeren som kallas M-linjen..
Andra proteiner
Det finns andra proteiner som är associerade med de tjocka myofilamenten som är kända som myosinbindande protein C och myomesin, som är ansvariga för fixeringen av myosinfilament i M-linjen.
Funktioner
Myofibriller har elementära konsekvenser för ryggradsdjurens rörelsekapacitet.
Eftersom de utgörs av de fibrösa och sammandragna proteinkomplexen i den muskulära apparaten är dessa väsentliga för att utföra svaren på nervstimuli som leder till rörelse och förskjutning (i skelettstrimmade muskler).
De obestridliga dynamiska egenskaperna hos skelettmuskulaturen, som omfattar mer än 40% av kroppsvikt, ges av myofibrillerna som samtidigt har mellan 50 och 70% av proteinerna i människokroppen..
Myofibrillerna, som en del av dessa muskler, deltar i alla dess funktioner:
- Mekanisk: omvandla kemisk energi till mekanisk energi för att generera kraft, bibehålla hållning, producera rörelser etc..
- Metabolisk: eftersom muskeln deltar i basal energimetabolism och fungerar som en lagringsplats för grundläggande ämnen såsom aminosyror och kolhydrater; Det bidrar också till produktion av värme och förbrukning av energi och syre som används under fysiska aktiviteter eller sportövningar.
Eftersom myofibriller huvudsakligen består av proteiner representerar de ett lagrings- och frisättningsställe för aminosyror som bidrar till upprätthållandet av blodsockernivåer under fasta eller svält..
Frigöringen av aminosyror från dessa muskulära strukturer är också viktig ur synvinkeln för de biosyntetiska behoven hos andra vävnader såsom hud, hjärna, hjärta och andra organ..
Referenser
- Despopoulos, A., & Silbernagl, S. (2003). Färgatlas för fysiologi (5: e upplagan). New York: Thieme.
- Friedman, A. L. och Goldman, Y. E. (1996). Mekanisk karakterisering av skelettmuskelfibrer. Biofysisk tidskrift, 71(5), 2774-2785.
- Frontera, W. R., och Ochala, J. (2014). Skelettmuskel: En kort genomgång av struktur och funktion. Calcif Tissue Int, Fyra fem(2), 183-195.
- Goldspink, G. (1970). Spridningen av myofibriller under muskelfibertillväxt. J. Cell Sct., 6, 593-603.
- Murray, R., Bender, D., Botham, K., Kennelly, P., Rodwell, V., & Weil, P. (2009). Harpers illustrerade biokemi (28: e upplagan). McGraw-Hill Medical.
- Rosen, J. N. och Baylies, M. K. (2017). Myofibriller lägger pressen på kärnor. Naturcellbiologi, 19(10).
- Sanger, J., Wangs, J., Fan, Y., White, J., Mi-Mi, L., Dube, D., ... Pruyne, D. (2016). Montering och underhåll av myofibriller i striated muskel. I Handbok för experimentell farmakologi (s 37). New York, USA: Springer International Publishing Schweiz.
- Sanger, J. W., Wang, J., Fan, Y., White, J., & Sanger, J. M. (2010). Montering och dynamik av myofibriller. Journal of Biomedicine and Biotechnology, 2010, 8.
- Sobieszek, A., & Bremel, R. (1975). Beredning och egenskaper hos ryggradslösa släta muskler - myofibriller och actomyosin. Europeiska tidskriften för biokemi, 55(1), 49-60.
- Villee, C., Walker, W., & Smith, F. (1963). Allmän zoologi (2: a upplagan). London: W. B. Saunders Company.


Ingen har kommenterat den här artikeln än.