
Litiumbromidstruktur, egenskaper, användningsområden, risker
De litiumbromid det är ett neutralt salt av en alkalimetall vars kemiska formel är LiBr. Formeln uttrycker att dess kristallina fasta ämne består av Li-joner+ och Br- i förhållandet 1: 1. Dess kristaller är vita eller ljusbeige. Det är mycket lösligt i vatten och det är också ett ganska hygroskopiskt salt..
Denna sista egenskap tillåter användning som torkmedel i luftkonditionerings- och kylsystem. Likaledes användes litiumbromid sedan början av 1900-talet vid behandling av vissa psykiska sjukdomar, varvid användningen övergavs på grund av olämplig användning av salt.
LiBr produceras genom behandling av litiumkarbonat, LitvåCO3, med bromvätesyra. Efter uppvärmning av mediet fälls det ut ur den vattenhaltiga lösningen som ett hydrat..
Detta salt irriterar huden och ögonen vid kontakt, medan det orsakar irritation i andningsvägarna genom inandning. Intag av litiumsalter kan orsaka illamående, kräkningar, diarré och yrsel.
Artikelindex
- 1 Struktur av litiumbromid
- 1.1 Hydrater och glasögon
- 2 fastigheter
- 2.1 Molekylvikt
- 2.2 Utseende
- 2.3 Lukt
- 2.4 Smältpunkt
- 2.5 Kokpunkt
- 2.6 Löslighet i vatten
- 2.7 Löslighet i organiska lösningsmedel
- 2.8 Brytningsindex (ηD)
- 2.9 Värmekapacitet
- 2.10 Standard molär entropi (Sθ 298)
- 2.11 Flampunkt
- 2.12 Stabilitet
- 2.13 Sönderfall
- 2,14 pH
- 2.15 Reaktivitet
- 2.16 Produktion
- 3 Nomenklatur
- 4 användningsområden
- 4.1 Torkmedel
- 4.2 Fibrer
- 4.3 Farmaceutiska produkter
- 4.4 Beroligande medel
- 5 risker
- 5.1 Kontakt toxicitet
- 5.2 Förtäring
- 6 Referenser
Struktur av litiumbromid
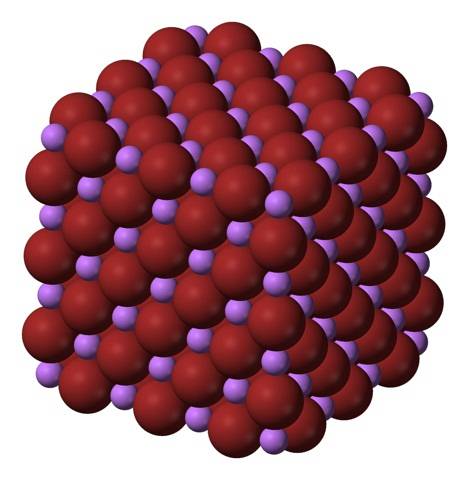
LiBr-formeln gör det klart att Li / Br-förhållandet är lika med 1; för varje Li-katjon+ det måste finnas en br anjon- motsvarighet. Därför måste detta förhållande hållas konstant i alla hörn av LiBr-kristallen..
Li-joner+ och Br- de lockar varandra och minskar avstötningarna mellan lika laddningar, för att på detta sätt ha en kubisk kristall som pärlsalt; detta är isomorf till NaCl (toppbild). Observera att hela uppsättningen i sig har en kubisk geometri.
I denna kristall, Li+ de är mindre och har en ljuslila färg; medan Br- de är mer voluminösa och har en djupbrun färg. Det observeras att varje jon har sex grannar, vilket är detsamma som att säga att de presenterar en oktaedrisk samordning: LiBr6 eller Li6Br; om enhetscellen beaktas förblir dock Li / Br-förhållandet 1.
Detta är kristallstrukturen, företrädesvis antagen av LiBr. Det kan emellertid också bilda andra typer av kristaller: wurzit, om det kristalliserar vid låga temperaturer (-50 ° C) på ett substrat; eller kroppscentrerad kubik, eller CsCl-typ, om den kubiska pärlsaltkristallen utsätts för under högt tryck.
Hydrater och glasögon
Det föregående gäller för vattenfri LiBr. Detta salt är hygroskopiskt och kan därför absorbera fukt från miljön och införa vattenmolekyler i sina egna kristaller. Således uppstår hydraterna LiBrnHtvåO (n = 1, 2, 3…, 10). För varje hydrat är kristallstrukturen annorlunda.
Till exempel bestämde kristallografiska studier att LiBrHtvåEller anta en perovskitliknande struktur.
När dessa hydrater är i vattenlösning kan de underkylas och förglasas; det vill säga, de antar en till synes kristallin men molekylärt störd struktur. Under sådana förhållanden blir vätebindningar i vatten ganska viktiga..
Egenskaper
Molekylvikt
88,845 g / mol.
Utseende
Vitt eller ljusbeige kristallint fast ämne.
Odör
Toalett.
Smältpunkt
552 ºC (1.026 ºF, 825 K).
Kokpunkt
1256 ºC (2,309 ºF, 1,538 K).
Vattenlöslighet
166,7 g / 100 ml vid 20 ° C Notera dess höga löslighet.
Löslighet i organiska lösningsmedel
Lösligt i metanol, etanol, eter och aceton. Något lösligt i pyridin, en aromatisk förening och mindre polär än de tidigare.
Brytningsindex (ηD)
1784.
Kaloriförmåga
51,88 J / mol K.
Standard molär entropi (Sθ 298)
66,9 J / mol K.
antändningspunkt
1265 ° C Det anses vara icke-brandfarligt.
Stabilitet
Stabil. Den vattenfria formen är emellertid extremt hygroskopisk.
Sönderfall
När den sönderdelas genom uppvärmning producerar den litiumoxid.
pH
Mellan pH 6 och 7 i vattenlösning (100 g / L, 20 ºC).
Reaktivitet
Litiumbromid reagerar inte under normala miljöförhållanden. Du kan dock uppleva starka reaktioner med starka syror när temperaturen ökar..
Vid upplösning i vatten ökar temperaturen, orsakad av en negativ hydratisering.
Produktion
LiBr produceras genom att reagera litiumhydroxid eller litiumkarbonat med bromvätesyra i en neutraliseringsreaktion:
LitvåCO3 + HBr => LiBr + COtvå + HtvåELLER
Litiumbromid erhålls som hydrat. För att erhålla den vattenfria formen är det nödvändigt att värma det hydratiserade saltet under vakuum..
Nomenklatur
Namnet "litiumbromid" härstammar från det faktum att det är en metallhalogenid, så benämnd enligt stamnomenklaturen. Andra namn, lika giltiga men mindre använda, är litiummonobromid, enligt den systematiska nomenklaturen; och litisk bromid (den unika valensen +1 för litium), enligt den traditionella nomenklaturen.
Applikationer
Torkmedel
LiBr är ett hygroskopiskt salt som bildar en koncentrerad saltlösning som kan absorbera fukt från luften över ett brett temperaturområde. Denna saltlösning används som torkmedel i luftkonditionerings- och kylsystem..
Fibrer
Det används för att öka volymen av ull, hår och andra organiska fibrer.
Farmaceutiska produkter
LiBr bildar addukter med vissa farmaceutiska föreningar, vilket modulerar deras verkan. En addukt är kombinationen genom koordination av två eller flera molekyler, utan att producera en strukturell förändring av någon av de sammanfogade molekylerna.
Lugnande
Litiumbromid användes först som ett lugnande medel vid vissa psykiska störningar, och det avbröts 1940. För närvarande används litiumkarbonat; men i vilket fall som helst är litium det element som utövar den terapeutiska verkan i båda föreningarna.
Litium används vid behandling av bipolär sjukdom, efter att ha varit användbart vid kontroll av maniska episoder av störningen. Litium tros hämma aktiviteten hos exciterande neurotransmittorer, såsom dopamin och glutaminsyra.
Å andra sidan ökar det aktiviteten hos det hämmande systemet som medieras av neurotransmittorn gamma-amino-smörsyra (GABA). Dessa åtgärder kan utgöra en del av grunden för den terapeutiska effekten av litium.
Risker
Kontakt toxicitet
Hudirritation och sensibilisering, allergier. Allvarlig ögonskada eller irritation i ögonen, luftvägarna, näsgångarna och halsen.
Förtäring
De viktigaste symtomen på grund av intag av litiumbromid är: gastrointestinala störningar, kräkningar och illamående. Andra negativa effekter av intag av salt inkluderar agitation, spasmer och medvetslöshet..
Det tillstånd som kallas "bromism" kan uppträda med litiumbromiddoser som är större än 225 mg / dag..
Några av följande tecken och symtom kan förekomma i skämt: akneförvärring och aptitlöshet, skakningar, talproblem, apati, svaghet och manisk agitation.
Referenser
- Kemisk formulering. (2019). Litiumbromid. Återställd från: formulacionquimica.com
- David C. Johnson. (10 juli 2008). Ny order på litiumbromid. Natur. doi.org/10.1038/454174a
- Aayushi Jain & R.C. Dixit. (s.f.). Strukturfasövergång i litiumbromid: Effekt av tryck och temperatur. [PDF]. Återställd från: ncpcm.in
- Takamuku et al. (1997). Röntgendiffraktionsstudier på superkylda vattenbaserade litiumbromid- och litiumjodidlösningar. Institutionen för kemi, naturvetenskapliga fakulteten, Fukuoka University, Nanakuma, Jonan-ku, Fukuoka 814-80, Japan.
- Nationellt centrum för bioteknikinformation. (2019). Litiumbromid. PubChem-databas, CID = 82050. Återställd från: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Litiumbromid. Återställd från: en.wikipedia.org
- Royal Society of Chemistry. (2019). Litiumbromid. Chemspider. Återställd från: chemspider.com


Ingen har kommenterat den här artikeln än.