
Myoglobinstruktur, funktion, normala värden
De myoglobin Det är ett globulärt intracellulärt protein som finns i cytosolen i skelett- och hjärtmuskelceller. Dess grundläggande funktion är att utgöra en syrereserv och att främja den intracellulära transporten av syre..
John Kendrew och Max Perutz fick Nobelpriset i kemi 1962 för sina studier om globulära proteiner. Dessa författare klargjorde den tredimensionella strukturen av myoglobin respektive hemoglobin. Historiskt sett var myoglobin ett av de första proteinerna från vilka den tredimensionella strukturen bestämdes..
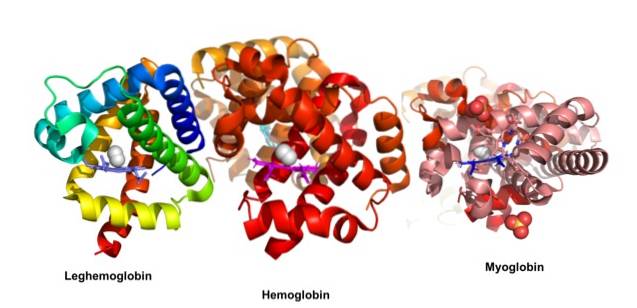
Globulära proteiner är kompakta molekyler med en sfärisk form; de är lösliga i cytosolen eller i lipiddelen i cellmembran. De är ansvariga för de viktigaste biologiska åtgärderna, i motsats till fibrösa proteiner, vars huvudfunktioner är strukturella.
Myoglobin ger färskt kött sin röda färg. Detta inträffar när myoglobin syresatt som oxymyoglobin och järnet som komponerar det är i form av järn: Mb-Fe2 + O2.
När köttet utsätts för miljön oxiderar det instabila järnet och blir järn och under dessa förhållanden ändras färgen till bruna toner på grund av bildandet av metamyoglobin (Mb-Fe3 + + O2 ● -).
Normalt är blodmyoglobinnivåerna mycket små, i storleksordningen mikrogram per liter (μg / L). Dessa nivåer ökar när muskelförstörelse inträffar som vid skelettmuskler rabdomyolys eller vid hjärtinfarkt med vävnadsförstöring och i vissa myopatier..
Dess närvaro i urinen observeras under vissa förhållanden där vävnadsskador är mycket viktiga. Dess tidiga diagnostiska värde för hjärtinfarkt är diskutabelt.
Artikelindex
- 1 Myoglobins struktur
- 2 Funktion
- 2.1 Typer av muskelfibrer och myoglobin
- 3 Normala värden
- 4 Referenser
Myoglobins struktur
Myoglobin har en molekylvikt på nästan 18 kDa inklusive hemgruppen. Den består av fyra spiralformade segment förenade med "skarpa svängar". Dessa myoglobinhelixar är tätt packade och bibehåller sin strukturella integritet även när hemgruppen avlägsnas..
Strukturen för globulära proteiner, liksom för alla cellulära proteiner, är hierarkisk så myoglobins struktur är också hierarkisk. Den första nivån är den primära strukturen som bildas av den linjära aminosyrasekvensen och myoglobin utgörs av en kedja av 153 aminosyror..
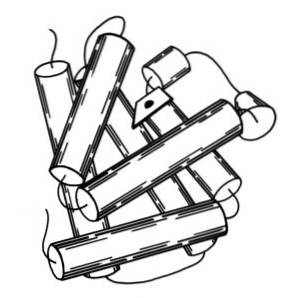
Den sekundära strukturen hos myoglobin består av konformationen av alfa-spiralerna. Myoglobin innehåller 8 alfa-helixer som bildas genom att upprepa polypeptiddelar som förenas av korta segment av aperiodiskt arrangemang..
Den tertiära strukturen består av den tredimensionella anpassningen till biologisk aktivitet. De viktigaste egenskaperna hos denna struktur är veck. Den kvartära strukturen avser sammansättningen av två eller flera polypeptidkedjor separerade och förenade genom icke-kovalenta bindningar eller interaktioner..
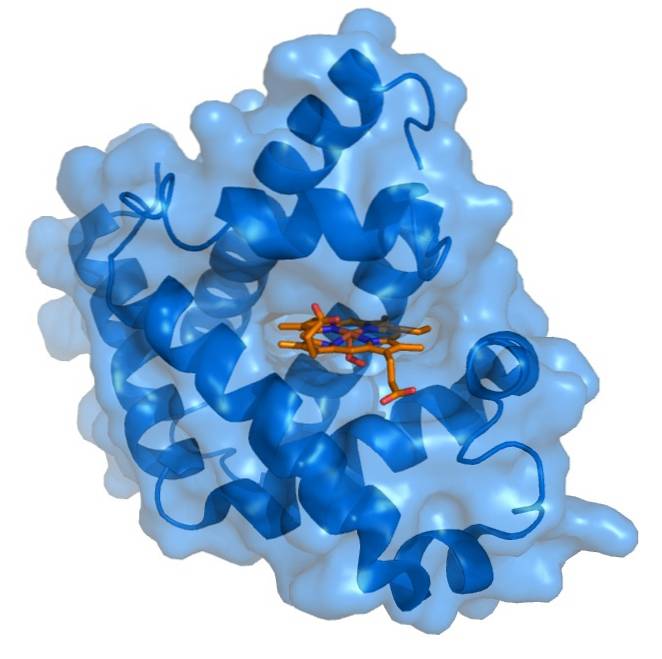
Myoglobin har en mycket kompakt struktur med hydrofoba rester riktade inåt och hydrofila eller polära rester riktade utåt. De inre apolära resterna består av leucin, valin, metionin och fenylalanin. De enda interna polära resterna är två histidiner som har funktioner i det aktiva centrumet..
Hemprotesgruppen är belägen i en klyfta i den apolära inre delen av polypeptidkedjan av myoglobin. Denna grupp innehåller järn i form av järn, som binder med syre för att bilda oxymyoglobin..
Fungera
Myoglobins funktion är att binda syre till hemgruppen i dess struktur och bilda en syrereserv för muskelfunktion. Eftersom syre fångas upp i myoglobinstrukturen i muskelcellens cytoplasma förblir dess intracellulära tryck, bestämt av fritt syre, lågt..
Lågt intracellulärt syretryck bibehåller gradienten för syreinträde i cellen. Detta gynnar syrepassagen från blodomloppet till muskelcellen. När myoglobin är mättat ökar intracellulärt syre, vilket gradvis minskar gradienten och därmed minskar överföringen.
Syrebindningskurvan till myoglobin är hyperbolisk. I de första delarna av kurvan, ger små förändringar i syretets partiella tryck stora förändringar i mättnaden av myoglobin med syre..
När syretrycket ökar fortsätter mättnaden att öka, men långsammare, det vill säga en mycket större ökning av syretets partiella tryck behövs för att öka mättnaden av myoglobin och gradvis plattas kurvan.
Det finns en variabel som mäter affiniteten för kurvan P50, detta representerar det partiella trycket av syre som är nödvändigt för att mätta myoglobinet i en lösning med 50%. Således, om P50 ökar, sägs det att myoglobin har mindre affinitet och om P50 minskar sägs det att myoglobin har en högre affinitet för syre..
När syrebindningskurvorna för myoglobin och hemoglobin undersöks observeras det att för eventuellt undersökt syretryck blir myoglobin mer mättat än hemoglobin, vilket indikerar att myoglobin har en högre affinitet för syre än hemoglobin.
Typer av muskelfibrer och myoglobin
Skelettmuskler har olika typer av muskelfibrer i sin sammansättning, vissa kallas långsam-ryckning och andra snabb-ryckning. Snabba fibrer är strukturellt och metaboliskt anpassade för att snabbt och kraftigt och anaerobt kontraheras.
Långsamma ryckfibrer är anpassade för långsammare men längre sammandragningar som är typiska för motstånd aerob träning. En av de strukturella skillnaderna för dessa fibrer är koncentrationen av myoglobin, vilket ger dem namnet vita och röda fibrer..
Röda fibrer har ett högt innehåll av myoglobin, vilket ger dem sin röda färg, men gör det också möjligt för dem att bibehålla stora mängder syre, vilket är viktigt för deras funktion..
Normala värden
Normala blodvärden för män är 19 till 92 µg / l och för kvinnor 12 till 76 µg / l, men det finns skillnader i värdena i de olika laboratorierna..
Dessa värden ökar när muskelförstöring inträffar, som förekommer vid rabdomyolys i skelettmuskler, vid omfattande brännskador, elektriska stötar eller vid omfattande muskelnekros på grund av arteriell ocklusion, i hjärtinfarkt och i vissa myopatier..
Under dessa förhållanden uppträder myoglobin i urinen och ger det en karakteristisk färg..
Referenser
- Fauci, A. S., Kasper, D. L., Hauser, S. L., Jameson, J. L. och Loscalzo, J. (2012). Harrisons principer för internmedicin. D. L. Longo (red.). New York: Mcgraw-hill
- Ganong WF: Central Regulation of Visceral Function, i Granskning av medicinsk fysiologi, 25: e upplagan New York, McGraw-Hill Education, 2016.
- Guyton AC, Hall JE: Body Fluid Compartments: Extracellular and intracellular fluids; Ödem, i Lärobok för medicinsk fysiologi, 13: e upplagan, AC Guyton, JE Hall (red.). Philadelphia, Elsevier Inc., 2016.
- McCance, K. L., & Huether, S. E. (2018). Patofysiologi-Ebook: den biologiska grunden för sjukdom hos vuxna och barn. Elsevier Health Sciences.
- Murray, R. K., Granner, D. K., Mayes, P. A., & Rodwell, V. W. (2014). Harpers illustrerade biokemi. Mcgraw-hill.


Ingen har kommenterat den här artikeln än.