
Dipolmoment hur det beräknas och exempel
De dipolmoment är en kemisk egenskap som indikerar hur heterogent elektriska laddningar fördelas i en molekyl. Det uttrycks i Debye-enheter, 3,33 · 10-30 C · m, och i allmänhet sträcker sig dess värden från 0 till 11 D.
Högpolära föreningar tenderar att ha stora dipolmoment; medan de apolära, små dipolmoment. Ju mer polariserade de elektriska laddningarna är i en molekyl, desto större är dess dipolmoment; det måste finnas en region rik på elektroner, δ- och en annan fattig på elektroner, δ+.

Dipolmomentet, μ, är en vektorstorlek, så det påverkas av bindningsvinklarna och i allmänhet av molekylstrukturen.
När molekylen är linjär kan den jämföras med ett tvåfärgsgummi. Dess negativa ände δ-, skulle motsvara färgen röd; medan det positiva, δ +, skulle vara den blå färgen. När magnituden av de negativa laddningarna vid δ-polen ökar och avståndet som skiljer den från δ + ökar dipolmomentet.
Kemiskt betyder detta att ju större skillnad i elektronegativitet mellan två atomer, och ju längre avståndet som skiljer dem, desto större är dipolmomentet mellan dem..
Artikelindex
- 1 Hur beräknas dipolmomentet?
- 2 Exempel
- 2.1 Vatten
- 2.2 Metanol
- 2.3 Ammoniak
- 2.4 Etanol
- 2.5 Koldioxid
- 2.6 Metan
- 3 Referenser
Hur beräknar du dipolmomentet?
Det anses vara en kovalent bindning mellan två atomer, A och B:
A-B
Avståndet mellan de positiva och negativa partiladdningarna definieras redan av längden på deras obligation:
TILL5+-B5-
Eftersom protoner och elektroner har samma storleksordning av elektrisk laddning men med motsatta tecken, 1.6 · 10-19C, detta är den som beaktas vid utvärdering av dipolmomentet mellan A och B med användning av följande ekvation:
μ = δd
Där μ är dipolmomentet är δ elektronens laddning utan negativtecken och d längden på länken uttryckt i meter. Till exempel antar vi det d har ett värde på 2 Å (1 10-10m) dipolmomentet, μA-B kommer att vara:
μA-B = (1,6 10-19C) · (2-10-10m)
= 3,210-29Centimeter
Men eftersom detta värde är mycket litet används Debye-enheten:
μ = (3,210-29C · m) · (1 D / 3,33 · 10-30 Centimeter)
= 9,60 D
Detta värde av μA-B kan ge för att anta att bindningen A-B är mer jonisk än kovalent.
Exempel
Vatten
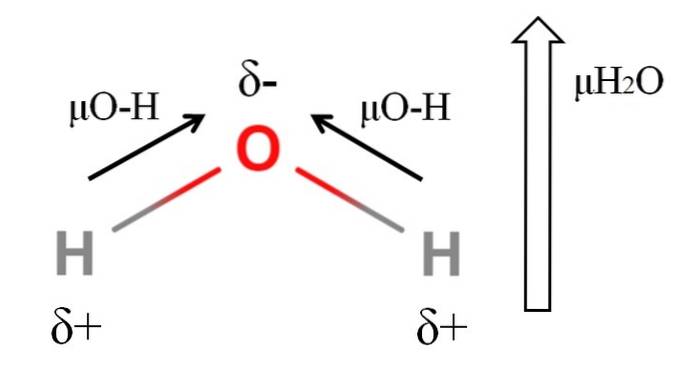
För att beräkna dipolmomentet för en molekyl måste alla dipolmoment för deras respektive bindningar läggas till vektorellt, med tanke på bindningsvinklarna och lite trigonometri. Detta i början.
Vatten har ett av de största dipolmomenten som kan förväntas för en kovalent förening. I den övre bilden har vi att väteatomer har positiva partiella laddningar, δ +, medan syre bär en negativ partiell laddning, δ-. O-H-bindningen är ganska polär (1,5D), och det finns två av dem i en H-molekyltvåELLER.
Vanligtvis dras en vektor som riktas från den minst elektronegativa atomen (H) till den mest elektronegativa (O). Även om de inte dras finns det på syreatomen två par odelade elektroner som ytterligare "koncentrerar" den negativa regionen..
På grund av H-vinkelgeometrintvåEller dipolmomenten lägger till i syreatomens riktning. Observera att summan av de två μO-H skulle ge 3D (1,5 + 1,5); men det är inte så. Dipolmomentet för vatten har ett experimentellt värde på 1,85D. Effekten av den nära 105 ° vinkeln mellan H-O-H-bindningarna visas här..
Metanol
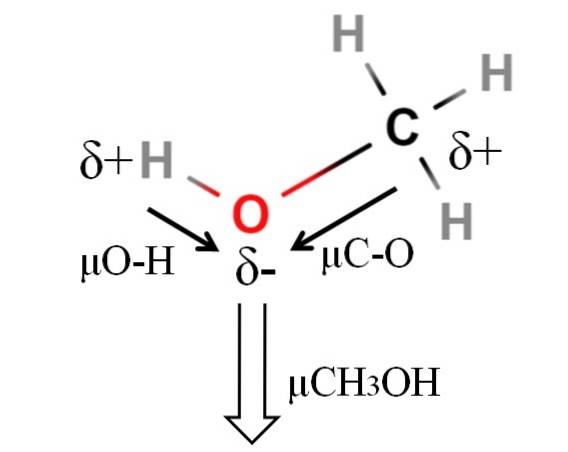
Dipolmomentet för metanol är 1,69 D. Det är mindre än för vatten. Därför har atommassorna inte mycket inflytande på dipolmomentet; men deras atomradier är. När det gäller metanol kan vi inte bekräfta att dess H-O-bindning har en μ lika med 1,5D; eftersom de molekylära miljöerna är olika i CH3OH och HtvåELLER.
Det är därför längden på H-O-bindningen i metanol måste mätas för att beräkna μO-H. Vad som kan sägas är att μO-H är större än μC-O, eftersom elektronegativitetsskillnaden mellan kol och syre är mindre än mellan väte och syre..
Metanol listas som ett av de mest polära lösningsmedlen som finns tillsammans med vatten och ammoniak..
Ammoniak
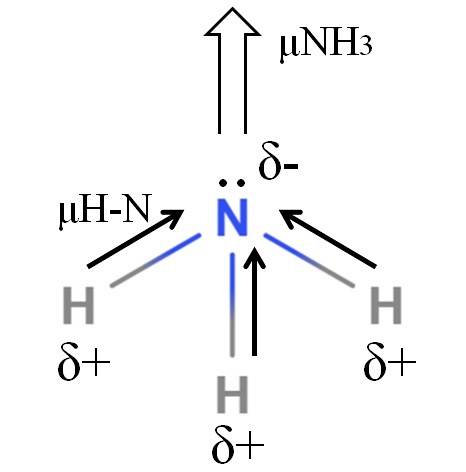
H-N-bindningarna är ganska polära, så kväve, på grund av sin högre elektronegativitet, lockar elektroner mot sig själv (övre bild). Utöver detta har vi ett odelat elektronpar som bidrar med deras negativa laddningar till δ-regionen. Därför dominerar elektriska laddningar på ammoniakens kväveatom..
Ammoniak har ett dipolmoment på 1,42 D, mindre än metanol. Om både ammoniak och metanol kunde omvandlas till drag, skulle det ses att metanoldraget har mer definierade poler jämfört med ammoniakdragningen.
Etanol
När det gäller etanol, CH3CHtvåOH, dess dipolmoment är mycket nära det för metanol, men det tenderar att ha lägre värden. Eftersom det finns fler kolatomer som utgör δ + -regionen börjar syreatomen som representerar δ- att förlora lite av sin "relativa negativa intensitet".
Koldioxid
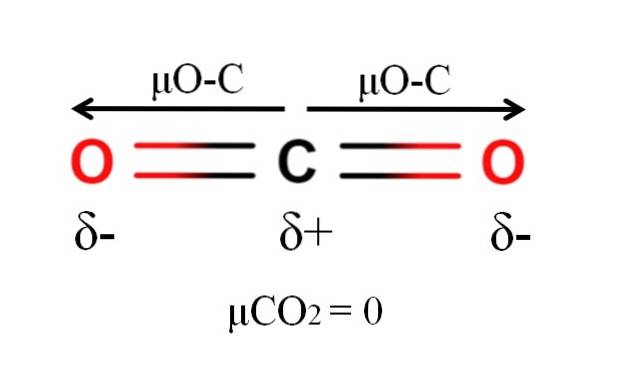
Koldioxid har två polära bindningar, C = O, med respektive dipolmoment μO-C. Som framgår av bilden ovan är emellertid den linjära geometrin för COtvå får de två μO-C att avbryta varandra i vektor, även när kol har en positiv partiell laddning och oxygener har negativa partiella laddningar.
Av denna anledning är koldioxid en apolär molekyl, eftersom μCOtvå har ett värde på 0D.
Metan
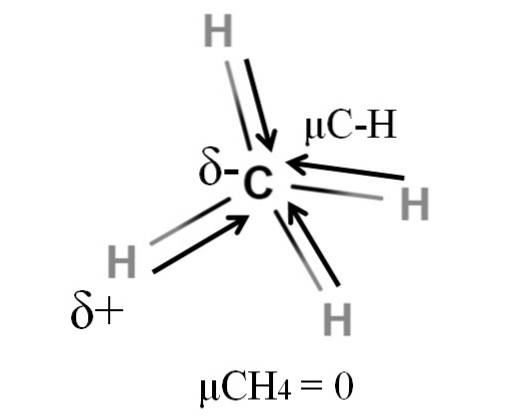
Både metan och koldioxid delar något gemensamt: de är mycket symmetriska molekyler. Generellt är ju mer symmetrisk en molekyl desto mindre är dess dipolmoment..
Om vi ser CH-molekylen4, dess CH-bindningar är polära, och elektronerna riktas mot kolatomen eftersom den är något mer elektronegativ. Man kan tro att kol måste vara en mycket negativ δ-region; som ett suddgummi med sitt djupa röda centrum och blåaktiga ändar.
Men genom att dela CH4 i hälften skulle vi få två HC-H-halvor, en till vänster och den andra till höger, liknande H-molekylentvåO. Således skulle dipolmomentet som härrör från tillsats av dessa två μC-H avbrytas med det för den andra halvan. Och därför, μCH4 har ett värde på 0D.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Walter J. Moore. (1963). Fysisk kemi. Inom kemisk kinetik. Fjärde upplagan, Longmans.
- Ira N. Levine. (2009). Principer för fysikalisk kemi. Sjätte upplagan, s. 479-540. Mc Graw Hill.
- Helmenstine, Anne Marie, Ph.D. (29 januari 2020). Dipole Moment Definition. Återställd från: thoughtco.com
- Blaber Mike. (29 september 2019). Dipole Moments. Kemi LibreTexts. Återställd från: chem.libretexts.org
- LaRita Williams. (2020). Dipole Moment: Definition, ekvation och exempel. Studie. Återställd från: study.com
- Wikipedia. (2020). Bond dipol ögonblick. Återställd från: en.wikipedia.org



Ingen har kommenterat den här artikeln än.