
Kaliumnitrit (KNO2) struktur, egenskaper och användningsområden

De kaliumnitrit är ett oorganiskt salt vars kemiska formel är KNOtvå, som är kemiskt och farmakologiskt relaterat till kaliumnitrat, KNO3. Dess fysiska utseende består av gulvita kristaller, mycket hygroskopiska och därmed delikat; de löser sig snabbt i fuktiga miljöer.
Dess formel indikerar att andelen K-joner+ och nejtvå- är 1: 1, och de hålls samman av elektrostatiska krafter eller jonbindningar. Inga rena naturliga källor verkar ha hittats för dess kristaller, även om nitritanjoner kan hittas i jord, gödselmedel, växter och djur..

Bilden ovan visar hur KNO-kristallerna ser uttvå, med uttalade gula toner. Om dessa kristaller lämnas i kontakt med luften absorberar de fukt tills de blir en vattenlösning; lösning som har genererat kontroverser om huruvida dess användning för medicinska ändamål är fördelaktig.
Å andra sidan används dess kristaller i mycket små mängder (200 ppm) för att salta kött och garantera att de bevaras mot bakterieverkan. På samma sätt KNOtvå förbättrar köttets färg, vilket gör dem mer rödaktiga; det är dock föremål för flera begränsningar för att undvika de toxiska effekterna av detta salt i kroppen.
Artikelindex
- 1 Struktur av kaliumnitrit
- 2 fastigheter
- 2.1 Molekylär massa
- 2.2 Densitet
- 2.3 Smältpunkt
- 2.4 Kokpunkt
- 2.5 Löslighet i vatten
- 2.6 Deliquescence
- 2.7 Löslighet i andra lösningsmedel
- 2,8 pH
- 3 Nomenklatur
- 4 Skaffa
- 5 användningsområden
- 5.1 Tillsatsmedel och reagens
- 5.2 Motgift
- 5.3 Läkare
- 6 Referenser
Struktur av kaliumnitrit
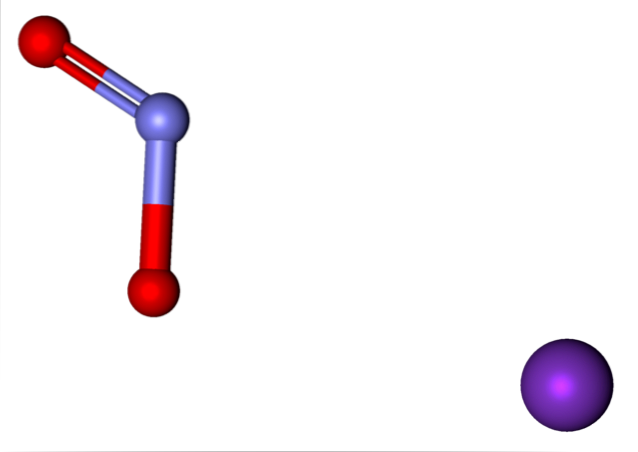
Jonerna närvarande i kaliumnitrit visas ovan. K-katjonen+ motsvarar den lila sfären, medan NO-anjonentvå- representeras av de blåaktiga och röda kulorna.
Anion NEJtvå- visas med en dubbel och en enkelbindning [O = N-O]-; men i själva verket är båda bindningarna lika produkt av den negativa laddningens resonans mellan dem.
K-joner+ och nejtvå- de lockar varandra i rymden tills de organiserar ett strukturellt mönster med minst energi; detta är, där avstängningarna mellan lika laddningar är minimala. Och så skapar de KNO-kristallertvå, vars enhetscell är känslig för temperaturförändringar, vilken fas övergår.
Till exempel vid låga temperaturer (mindre än 25 ° C) KNO-kristallertvå anta ett monokliniskt system (fas I). När temperaturen överstiger 25 ° C sker en fasövergång från monoklin till rombohedral (fas II). Slutligen över 40 ° C KNO-kristallernatvå ändra till kubik (fas III).
På samma sätt KNOtvå den kan uppvisa andra kristallina faser (faser IV, V och VI) under höga tryck. Med detta K-jonerna+ och nejtvå- de hamnar i rörelse och ordning på olika sätt i sina rena kristaller.
Egenskaper
Molekylär massa
85,1038 g / mol.
Densitet
1,9150 g / ml.
Smältpunkt
440,02 ° C (men börjar sönderdelas från 350 ° C och avger giftiga ångor).
Kokpunkt
537 ° C (exploderar).
Vattenlöslighet
312 g / 100 g vatten vid 25 ° C.
Deliquescence
Dess löslighet i vatten är sådan att den är hygroskopisk; så mycket att den uppvisar delikatens och absorberar tillräckligt med fukt för att lösa sig. Denna affinitet för vatten kan bero på den energiska stabilitet som K-joner får+ när det är hydratiserat, samt en låg gitterentalpi för KNO-kristallertvå.
Kristaller kan absorbera vatten utan att lösa sig för att bli ett hydrat, KNOtvåHtvåO. I hydratet finns vattenmolekylen som följer med jonerna, vilket modifierar den kristallina strukturen.
Detta hydrat (eller flera av dem) kan bildas under -9 ° C; vid högre temperaturer löses vattnet upp och återfuktar jonerna och deformerar kristallen.
Löslighet i andra lösningsmedel
Lätt löslig i heta alkoholer och mycket löslig i ammoniak.
pH
6-9. Dess vattenlösningar är därför alkaliska, eftersom anjonen NOtvå- kan hydrolyseras.
Nomenklatur
Till KNOtvå det kan också namnges på andra sätt. "Kaliumnitrit" motsvarar namnet på detta salt enligt stamnomenklaturen. "kaliumnitrit", enligt den systematiska nomenklaturen, där den enda valensen av kalium, +1, är markerad; och kaliumdioxonitrat (III), enligt den systematiska nomenklaturen.
Namnet "kaliumdioxonitrat (III)" belyser kväveatomens +3-valens. Även om det är det mest rekommenderade namnet av IUPAC för KNOtvå, "kaliumnitrit" fortsätter att vara det mest bekväma och lättast att komma ihåg.
Erhållande
Det mest direkta sättet att syntetisera det, men med ett lägre utbyte, är genom termisk nedbrytning av kaliumnitrat eller saltpeter vid 400 ° C eller mer:
2KNO3 => KNOtvå + ELLERtvå
Men en del av KNOtvå Det slutar med att sönderdelas av värmen, förutom att andra produkter bildas.
En annan metod för att förbereda eller syntetisera den med ett högre utbyte är genom att minska KNO3 i närvaro av bly, koppar eller zink. Ekvationen för denna reaktion är som följer:
KNO3 + Pb => KNOtvå + PbO
Kaliumnitrat och bly blandas stökiometriskt i en järnspanna, där de smälter under konstant omrörning och upphettning i en halvtimme. Bly (II) -oxiden är gul i färg och den resulterande massan pulveriseras varm och behandlas med kokande vatten. Sedan filtreras den heta blandningen.
Det heta filtratet bubblas med koldioxid i fem minuter, vilket kommer att fälla ut blykarbonat, PbCO3, olöslig. På detta sätt separeras blyet från filtratet. Utspädd salpetersyra tillsätts till filtratet tills pH-värdet är neutralt, det får svalna och slutligen indunstas vattnet så att KNO-kristallerna bildas.två.
Applikationer
Tillsatsmedel och reagens
Kaliumnitrit används som tillsatsmedel för att bota rött kött, bibehåller dess smak och färg längre under lagring, samtidigt som bakterier och vissa toxiner, såsom botulinum, fördröjs. Därför uppvisar den antibakteriell verkan.
KNOtvå det oxiderar till NO, vilket reagerar med myoglobin i kött och följaktligen ändrar sin naturliga röda färg. Senare, när köttet tillagas, får det sin karakteristiska starka rosa färg.
Men under förhållanden utan att specificera KNOtvå reagerar med köttproteiner för att ge upphov till nitrosaminer, som kan bli cancerframkallande.
Å andra sidan KNOtvå (även om företrädesvis NaNOtvå) är ett analytiskt reagens som kan användas vid syntes av azofärgämnen (reaktion av salpetersyra med aromatiska aminer) och vid analys av aminosyror.
Motgift
Även om det har sina negativa effekter, KNOtvå fungerar som ett motgift hos patienter som förgiftas med cyanider och vätesulfid. Dess mekanism består av att oxidera Fe-centrentvå+ till tro3+ av grupperna har vi hemoglobinerna och producerar metemoglobin, som sedan reagerar med CN-anjonerna- och HS-.
Läkare
I magsaften i magen anjonen NOtvå- den reduceras till NO, vilket är känt för att ha en vasodilaterande verkan, vilket ökar blodflödet. I andra delar av kroppen där pH inte är tillräckligt surt, är vissa enzymer, såsom xantinoxidoreduktas, ansvariga för att minska NOtvå-.
KNO har använtstvå för att behandla sjukdomar och sjukdomar som angina pectoris och epilepsi (med mycket negativa biverkningar).
Referenser
- Wikipedia. (2019). Kaliumnitrit. Återställd från: en.wikipedia.org
- PrebChem. (2016). Beredning av kaliumnitrit. Återställd från: prepchem.com
- Mark Gilchrist, Angela C. Shore, Nigel Benjamin. (2011). Oorganiskt nitrat och nitrit och kontroll av blodtryck, kardiovaskulär forskning, volym 89, utgåva 3, 15 februari 2011, sidorna 492-498, doi.org/10.1093/cvr/cvq309
- PubChem. (2019). Kaliumnitrit. Återställd från: pubchem.ncbi.nlm.nih.gov
- Kemisk formulering. (2018). Kaliumnitrit. Återställd från: formulacionquimica.com
- National Center for Advancing Translational Sciences. (2011). Kaliumnitrit. Återställd från: drugss.ncats.io
- Richard J. Epley, Paul B. Addis och Joseph J. Warthesen. (1992). Nitrit i kött. University of Minnesota.
- N. R. Rao, B. Prakash och M. Natarajan. (1975). Transformationer av kristallstrukturer i oorganiska nitrit, nitrater och karbonater. Institutionen för kemi, Indian Institute of Technology, Kanpur, Indien.


Ingen har kommenterat den här artikeln än.