
Atomnummer
Vad är atomnumret?
Atomnumret för ett kemiskt element indikerar antalet protoner som finns i atomkärnan hos det grundämnet. I fallet att det var en neutral atom kommer atomnumret att sammanfalla med antalet elektroner i nämnda element.
Som känt består atomkärnan av protoner och neutroner. Protoner har en positiv laddning och deras värde sammanfaller med det absoluta värdet av elektronens negativa laddning, vilket är 1,6 x 10-19 coulomb i internationella systemenheter.
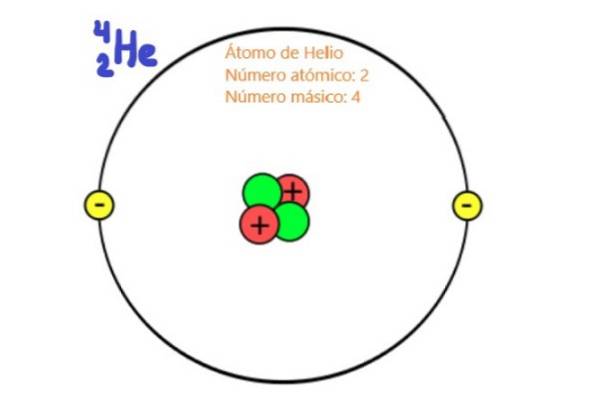
Eftersom de är partiklar i atomkärnan är protoner och neutroner kända som nukleoner. Det är dessa partiklar som praktiskt taget bestämmer atommassan, eftersom nukleonerna är ungefär två tusen gånger mer massiva än atomens elektroner. Av denna anledning kallas antalet nukleoner i en atom massnummer.
Men den atomnummer det är den som bestämmer atomarelementens kemiska affinitet, för i neutrala atomer sammanfaller detta antal med antalet elektroner.
Atomnummerrepresentation
I det periodiska systemet åtföljs symbolen X för ett kemiskt element på nedre vänstra sidan av siffran Z som representerar atomnummer för nämnda element, medan massantalet anges längst upp till vänster om elementets kemiska symbol. TILL.
Följande bild visar denna notation:
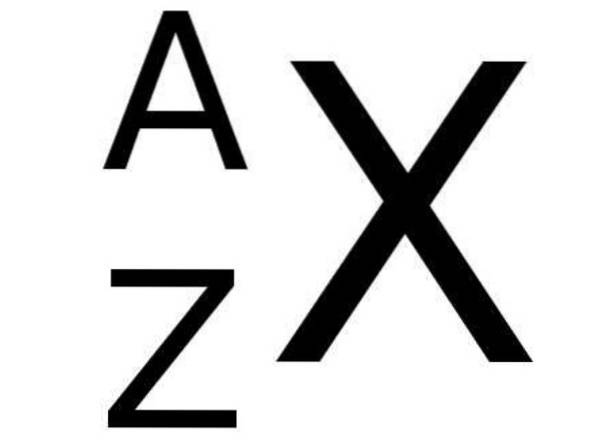
Och nedan visar tabell 1 några exempel på kemiska element med deras respektive notering och atom- och massnummer:
bord 1
| Element | Notation | Atomnummer Z | Massnummer A. |
|---|---|---|---|
| Väte | 1 1 H | 1 | 1 |
| Kol | 12 6 C | 6 | 12 |
| Syre | 16 8 ELLER | 8 | 16 |
| Uran | 238 92 ELLER | 92 | 238 |
Atomnummer och ordning på element i det periodiska systemet
Det periodiska systemet för kemiska grundämnen tillåter sekventiell ordning och i ökande ordning av elementen, i enlighet med värdet på deras atomnummer.
Minst 118 av dem är kända, med början med väte tills de når elementet 118 som är oganeson -innan du ringde ununoctium-, vars kemiska symbol är Og och dess massnummer är 294.
De första 10 kemiska elementen med ökande ordning i atomnummer är mycket mer bekanta. Så till exempel har vi det mest kända:
- Väte, H
- Helium, han
- Litium, Li
- Beryllium, Be
- Bor, B
- Kol, C
- Kväve, N
- Syre, O
- Fluor, F
- Neon, Ne

Elektronisk konfiguration
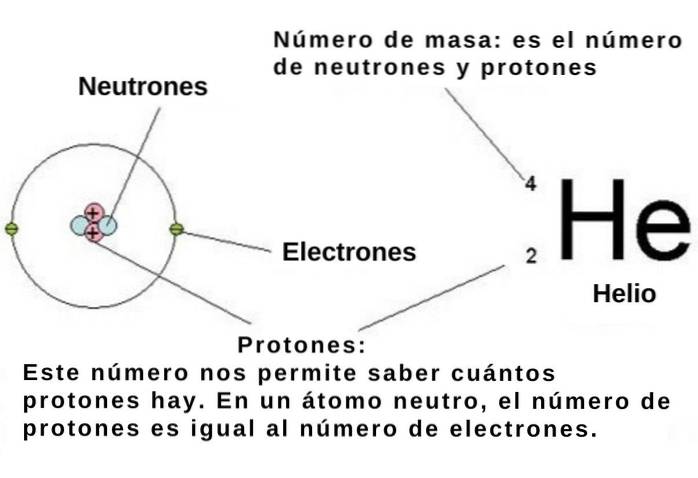
Atomtalet anger antalet protoner i atomkärnan hos ett kemiskt element och varje proton, som vi har sagt, har en elementär positiv laddning på 1 602 x 10-19 C.
Om atomen är neutral är antalet elementära negativt laddade elektroner -1,602 x10-19 C måste vara lika med atomnummer. Så, med kännedom om det kemiska grundämnets numeriska position i det periodiska systemet, är dess antal elektroner också känt..
I atomen ockuperar dessa elektroner regioner som kallas orbitaler, som beror på elektronens energi och vinkelmoment. I sin tur kvantiseras både energin och vinkelmomentet hos elektronerna i atomen. Detta innebär att de bara kan ta vissa diskreta värden.
Nu är orbitalerna fyllda med elektroner från lägre till högre energi, enligt vissa regler som bestämmer den elektroniska konfigurationen.
På detta sätt fastställer antalet elektroner i de yttersta orbitalerna eller nivåerna i en atom bindningarna som den kan bilda med andra atomer för att bilda molekyler. Detta antal beror på elektronkonfigurationen och atomnumret.
Kvantnummer
Energin hos en elektron i atomen bestäms av dess huvudsakliga kvantnummer n, som kan ta heltal värden 1, 2, 3 ...
Elektronens vinkelmoment i atomen bestäms av det sekundära kvantantalet l (bokstav ele) och dess värden beror på n.
Till exempel, för n = 2 tar det sekundära kvantantalet värdena från 0 till n-1, det vill säga: 0 och 1. På samma sätt, för n = 1 som är den lägsta energinivån, är det sekundära kvantantalet bara det tar värdet 0.
Sekundära kvantnummer 0, 1, 2, 3 betecknas växelvis med bokstäverna s, p, d och f. Orbitalerna är sfäriska och p-orbitalerna är lobulerade.
Det finns ytterligare två kvantnummer:
- Det magnetiska kvantantalet ml, som tar värdena från -l till + l genom noll.
- Snurrkvantantalet s, som bara tar värden + ½ och -½ och är en egenskap hos elektronen.
Slutligen finns det Pauli-uteslutningsprincipen, som säger att två elektroner inte kan ha alla fyra identiska kvantnummer. Som en konsekvens av denna princip kan en orbital ha maximalt två elektroner med motsatt snurrning.
Elektroniskt konfigurationsschema
Elektronkonfigurationsdiagrammet används för att veta ordningen för fyllning av elektronerna från orbitaler med lägst energi till högsta energi, när atomnumret för ett kemiskt element är känt. Figur 4 visar detta diagram:
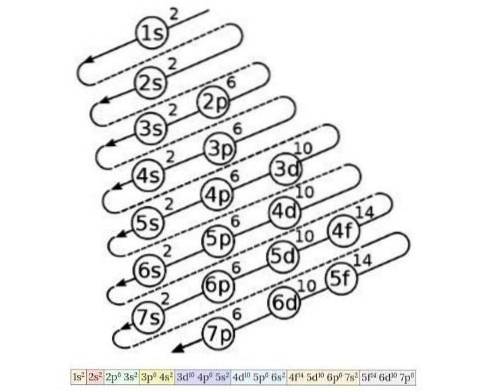
Idén som beskrivs där är följande: den första siffran indikerar det huvudsakliga kvantantalet, därefter indikerar bokstaven det sekundära kvantantalet, och slutligen indikerar det övre skriftnumret det maximala antalet elektroner som är möjligt i den banan..
Exempel
Elektronisk konfiguration av kol och kisel
Som anges ovan har kol atomnummer 6, vilket betyder att det har 6 elektroner som fördelas enligt följande: 1s2 2s2 2p2. För sin del har kisel atomnummer 14 och dess elektroner fördelas på detta annat sätt: 1s2 2s2 2p6 3s2 3p2.
Båda elementen finns i samma kolumn i det periodiska systemet, för även om de har olika atomnummer har de samma elektroniska konfiguration i det periodiska systemet. yttersta banan.
Referenser
- Connor, N. Vad är Nucleon - Atomic Nucleus Structure - Definition. Återställd från: periodic-table.org.
- Folkets toppmöte. Atomnummer: vad är det, hur representeras det. Återställd från: cumbrepuebloscop20.org
- Lifeder. Vad är kemisk periodicitet? Återställd från: lifeder.com
- Wikipedia. Elektronisk konfiguration. Återställd från: es.wikipedia.com
- Wikipedia. Atomnummer. Återställd från: es.wikipedia.com


Ingen har kommenterat den här artikeln än.