
Natriumhydroxid (NaOH) struktur, egenskaper, användningsområden, syntes

De natriumhydroxid Det är en oorganisk förening vars kemiska formel är NaOH och består av en mycket stark metallbas eller alkali. En 5% lösning av den i vatten har ett pH nära 14.
Det är ett mycket hygroskopiskt vitt fast ämne som också kan absorbera koldioxid från luften för att bilda natriumkarbonat. Det kommer kommersiellt i plastflaskor som piller, som inte kan exponeras för länge för luften, och de bör inte heller manipuleras med spatlar.

Natriumhydroxid kan syntetiseras genom att reagera kalciumhydroxid med natriumkarbonat. För närvarande syntetiseras den i grunden genom elektrolys av saltlösning och är en biprodukt från produktionen av klorgas.
Med tanke på den höga basen hos NaOH har den många användningsområden och applikationer, såsom produktion av papper, tvålar, tvättmedel, färgämnen etc. Det används också vid hushållsrengöring, vattenbehandling, aluminiumbearbetning, medicintillverkning etc. och framför allt är det ett sekundärt mönster par excellence.
Natriumhydroxid är mycket frätande och kan orsaka irritation och brännskador på hud och ögon. Genom att andas in dammet kan det orsaka lungödem. Samtidigt kan dess intag orsaka så allvarliga skador på mag-tarmkanalen att det kan leda till döden..
Artikelindex
- 1 Struktur
- 1.1 Vattenfri
- 1.2 Hydrater
- 2 Fysikaliska och kemiska egenskaper
- 2.1 Namn
- 2.2 Molmassa
- 2.3 Utseende
- 2.4 Smältpunkt
- 2.5 Kokpunkt
- 2.6 Löslighet i vatten
- 2.7 Grundläggande (pKb)
- 2,8 pH
- 2.9 Brytningsindex (nD)
- 2.10 Stabilitet
- 2.11 Sönderfall
- 2.12 Självantändningspunkt
- 2.13 Viskositet
- 2.14 Förångningsvärme
- 2.15 Ytspänning
- 2.16 Reaktivitet
- 3 Syntes
- 3.1 Reaktion av natriumkarbonat och kalciumhydroxid
- 3.2 Elektrolys av natriumklorid
- 4 användningsområden
- 4.1 Rengöringsprodukter
- 4.2 Läkemedel och läkemedel
- 4.3 Energiprocesser
- 4.4 Vattenbehandling
- 4.5 Papperstillverkning
- 4.6 Industriell tillverkning
- 5 risker
- 6 Referenser
Strukturera
Vattenfri

Den övre bilden visar jonerna som utgör NaOH. Na-katjonen+ representeras av den lila sfären, medan hydroxylanjonen (hydroxid eller hydroxyl) OH- vid den röda och vita sfären. Båda Na-jonerna+ och OH- interagerar med varandra genom den elektrostatiska attraktionen av deras motsatta laddningar.
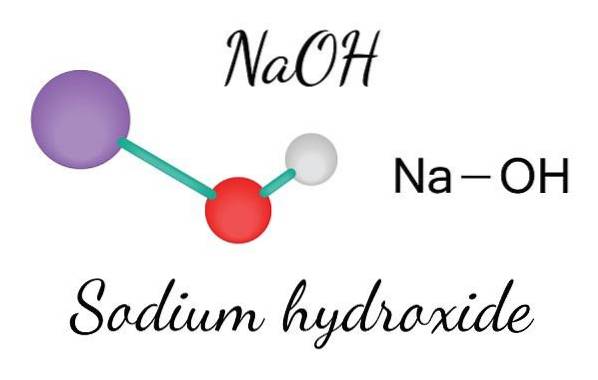
Sådana interaktioner är icke-riktade, så attraktionerna hos ett jonpar Na+Åh- det kan påverka andras på ett visst avstånd. Resultatet är att Na-jonerna+ stöter bort varandra, på samma sätt som OH-, tills de definierar en kristall av minsta energi där de etablerar en ordnad och periodisk struktur (kristallin).
Därför uppträder de ortorombiska kristallerna av vattenfri NaOH (utan vatten):
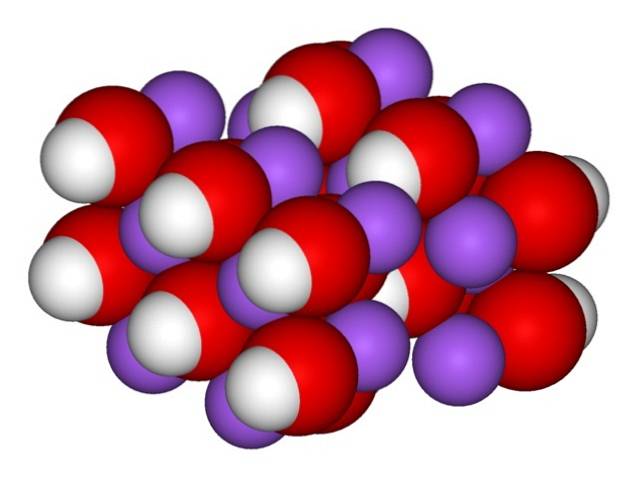
Jonerna förblir tillräckligt sammanhängande så att den vattenfria NaOH-kristallen smälter vid 323 ° C (så länge det inte finns någon fuktighet i miljön).
Hydrater
Både Na+ som OH- De är joner som vattenmolekyler lätt solvat (hydrat). Detta gynnar dess hydratisering över kristallernas retikulära energi, varför NaOH släpper ut mycket energi när den kommer i kontakt med vatten..
Vattenfria kristaller kan emellertid vara värd för olösta vattenmolekyler; dvs natriumhydroxid kan bilda ett flertal hydrater, NaOH nHtvåO. Vattenmolekylen kan mycket väl bilda en vätebindning med OH- (HOH-OH-), eller samordna med Na+ (Na+-Åhtvå).
Beroende på molförhållandet mellan NaOH och HtvåEller monohydrater (NaOHHtvåO), dihydrater (NaOH 2HtvåO), trihemidrater (NaOH 3,5HtvåO), tetrahydrater (NaOH 4HtvåO), heptahydrater (NaOH 7HtvåO) och mer.
Var och en av dessa hydrater kan kristallisera från en vattenlösning av NaOH med olika massprocent och vid olika temperaturer. Följaktligen uppvisar NaOH ett komplicerat vattenlöslighetsdiagram..
I allmänna termer är hydratkristallerna mindre täta och har lägre smältpunkter. Detta beror på att vattenmolekylerna "hindrar" interaktionen mellan Na+ och OH-, adderar dipol-dipolkrafter vid uppoffring av joniska attraktioner.
Fysiska och kemiska egenskaper
Namn
IUPAC föredraget namn: natriumhydroxid. Andra namn: kaustisk läsk, askarit (mindre vanligt)
Molmassa
39,9971 g / mol
Utseende
Vitt, seröst eller ogenomskinligt fast ämne eller kristaller.
Smältpunkt
323 ºC
Kokpunkt
1 388 ºC
Vattenlöslighet
1000 g / l vid en temperatur av 25 ° C. Detta visar hur mycket det kan lösas upp i vatten..
Deras vattenhaltiga lösningar är viskösa, med ett viskositetsvärde ungefär åttio gånger så mycket som vatten, och de släpper ut mycket värme först. Om du har kontakt med dem gör de huden hal, på grund av förtvålningen av fettsyrorna i huden..
Grundläggande (pKb)
- 0,56
pH
En 5% vikt / vikt-lösning i vatten har ett pH-värde nära 14
Brytningsindex (nD)
Vid en våglängd på 580,4 nm: 1433 vid 320 ° C och 1421 vid 420 ° C.
Stabilitet
Behållare som innehåller den måste stängas hermetiskt för att förhindra bildning av natriumkarbonat. Detta beror på dess höga hygroskopicitet, vilket leder till att den absorberar fukt från omgivningen och dess CO-innehåll.två.
Sönderfall
Vid uppvärmning till nedbrytning avger den natriumoxidrök.
Självantändningspunkt
Det är inte brandfarligt
Viskositet
4,0 cPoise vid 350 ºC
Förångningsvärme
175 kJ / mol vid 1388 ºC
Ytspänning
74,35 dyn / cm i en 2,72% vikt / vikt-lösning i vatten vid 18 ºC.
Reaktivitet
Med syror
Reagerar med organiska och oorganiska mineralsyror, vilket skapar vatten och motsvarande salt. När det gäller svavelsyra är reaktionen exoterm.
2 NaOH + HtvåSW4 => NatvåSW4 + 2 timmartvåELLER
Med syraoxider
Reagerar med svaveldioxid, till exempel, vilket ger ett sulfitsalt av och vatten:
2 NaOH + SOtvå => NatvåSW3 + HtvåELLER
Med metaller
De vattenhaltiga lösningarna reagerar med vissa metaller för att producera komplexa natriumsalter. Till exempel ger dess reaktion med zink upphov till ett natriumzinkat:
Zn + 2 NaOH + 2 HtvåO => Natvå[Zn (OH)4] + Htvå
Syntes
Natriumhydroxid syntetiseras huvudsakligen med två metoder: användningen av natriumkarbonat, som ursprungligen användes, och elektrolys av natriumklorid, för närvarande i större industriell användning..
Reaktion av natriumkarbonat och kalciumhydroxid
Natriumkarbonat reagerar med kalciumhydroxid i en process som kallas kaustisering:
Ca (OH)två + NatvåCO3 => CaCO3 + NaOH
Kalciumkarbonat fälls ut och lämnar natriumhydroxid i supernatanten, som koncentreras genom indunstning.
Natriumkarbonat kommer tidigare från Solvay-processen:
2 NaCl + CaCO3 => NatvåCO3 + CaCltvå
Elektrolys av natriumklorid
Elektrolysen av natriumklorid, närvarande i saltlösningen, producerar vätgas, kloridgas och natriumhydroxid i vattenlösning:
2 Nacl + 2 HtvåO => Htvå + Cltvå + 2 NaOH
Den elektrolytiska kammaren består av ett fack där anoden (+) är gjord av titanmetall och en plats där saltlösningen placeras. Detta fack separeras från katodfacket (-) med ett poröst membran..
Följande reaktion inträffar vid anoden:
2 Cl- => Cltvå + 2 e- (oxidation)
Under tiden sker denna reaktion vid katoden:
2 timmartvåO + 2 e- => Htvå + Åh- (minskning)
Natrium (Na+) diffunderar från anodfacket till katodfacket, genom membranet som separerar dem och bildar natriumhydroxid.
Applikationer
Rengöringsprodukter
Natriumhydroxid används för att göra tvålar och tvättmedel som används i hemmet och i näringslivet. Kombinationen av natriumhydroxid och klor ger klorblekmedel som används vid tvätt av vita kläder.
Det eliminerar också ackumuleringen av fett i avloppet och producerar dess eliminering genom dess omvandling till tvål genom förtvålningsprocessen. Detta möjliggör eliminering av blockering av rören i bostäderna och andra byggnader.
Läkemedel och läkemedel
Natriumhydroxid används för att göra vanliga smärtstillande medel, såsom aspirin. Även av läkemedel med antikoagulerande verkan som blockerar bildandet av blodproppar och läkemedel för att minska hyperkolesterolemi.
Energiprocesser
Natriumhydroxid används vid tillverkning av bränsleceller som fungerar som batterier för att producera elektricitet för en mängd olika applikationer, inklusive transport. Epoxihartser, tillverkade med ingripande av natriumhydroxid, används i vindkraftverk.
Vattenbehandling
Natriumhydroxid används för att neutralisera surheten i vattnet och bidra till avlägsnandet av tungmetaller från det. Det används också för produktion av natriumhypoklorit, ett vattendesinfektionsmedel.
Natriumhydroxid reageras med aluminiumsulfat för att bilda aluminiumhydroxid: ett flockningsmedel som används i vattenreningsverk för att öka sedimentationen av partiklar, vilket ger deras förtydligande..
Papperstillverkning
Natriumhydroxid används tillsammans med natriumsulfid vid behandling av trä för att erhålla cellulosa, i en nästan ren form, som ligger till grund för papper. Det används också vid återvinning av papper, eftersom det hjälper till att separera bläcket så att det kan användas igen.
Industriell tillverkning
Natriumhydroxid används vid tillverkning av rayon, spandex, sprängämnen, epoxihartser, glas och keramik. Det används i textilindustrin för att tillverka färgämnen och bearbeta bomullstyg.
I sockerrörsreningsverk används natriumhydroxid med låg temperatur för produktion av etanol från sockerrör.
Risker
Natriumhydroxid är en mycket frätande förening, så det kan orsaka brännskador, blåsor och till och med permanenta ärr genom hudkontakt.
Vid kontakt med ögonen kan det orsaka svåra brännskador, svullnad, smärta, dimsyn och i svåra fall kan det orsaka permanent blindhet..
Att svälja natriumhydroxid kan orsaka brännskador på läppar, tunga, hals, matstrupe och mage. Vanliga symtom inkluderar illamående, kräkningar, magkramper och diarré..
Även om inandning av natriumhydroxid är sällsynt och endast kan ske på grund av närvaron av damm av föreningen i luften eller från bildandet av en dimma som innehåller den, orsakar det irritation i lungorna..
Vid kronisk exponering kan detta orsaka lungödem och svår andfåddhet, vilket utgör en medicinsk nödsituation..
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Wikipedia. (2019). Natriumhydroxid. Återställd från: en.wikipedia.org
- Nationellt centrum för bioteknikinformation. (2019). Natriumhydroxid. PubChem-databas. CID = 14798. Återställd från: pubchem.ncbi.nlm.nih.gov
- Amerikanska element. (2019). Natriumhydroxidlösning. Återställd från: americanelements.com
- Fakta om kemisk säkerhet. (2019). Natriumhydroxid. Återställd från: chemicalafetyfacts.org
- NJ Hälsa. (2015). Natriumhydroxid. [PDF]. Återställd från: nj.gov
- Canadian Center for Occupational Health & Safety. (2019). OSH-svar Faktablad: natriumhydroxid. Återställd från: ccohs.ca
- Ausetute. (s.f.). Natriumhydroxid- och klorproduktion genom elektrolys. Återställd från: ausetute.com.au



Ingen har kommenterat den här artikeln än.