
Torr cellstruktur och funktion
A torr cell det är ett batteri vars elektrolytiska medium består av en pasta och inte en lösning. Nämnda pasta har emellertid en viss fuktighetsnivå och av dessa skäl är den inte torr..
Den lilla mängden vatten är tillräcklig för jonerna att röra sig och följaktligen strömmen av elektroner inuti cellen..

Dess enorma fördel jämfört med de första våta batterierna är att eftersom det är en elektrolytisk pasta kan innehållet inte spillas; vilket var fallet med våta batterier, som var farligare och känsligare än deras torra motsvarigheter. Med tanke på att det inte går att spilla, finner den torra cellen användning i många bärbara och mobila enheter.
På bilden ovan finns ett torrt zink-kolbatteri. Mer exakt är det en modern version av Georges Leclanché-stacken. Av allt är det det vanligaste och kanske det enklaste.
Dessa enheter representerar en energisk bekvämlighet på grund av att de har kemisk energi i fickan som kan omvandlas till elektricitet; och på detta sätt inte beroende av eluttag eller den energi som levereras av stora kraftverk och deras stora nätverk av torn och kablar.
Artikelindex
- 1 Torrcellens struktur
- 1.1 Elektroder
- 1.2 Terminaler
- 1.3 Sand och vax
- 2 Användning
- 2.1 Oxidation av zinkelektroden
- 2.2 Reduktion av ammoniumklorid
- 2.3 Ladda ner
- 3 Referenser
Torr cellstruktur
Vad är strukturen hos en torr cell? På bilden kan du se dess lock, som inte är mer än en polymerfilm, stål och de två terminalerna vars isolerande brickor sticker ut framifrån.
Detta är dock bara hans yttre utseende; dess viktigaste delar ligger inuti, vilket garanterar att den fungerar korrekt.
Varje torr cell kommer att ha sina egna egenskaper, men endast zink-kolcellen kommer att beaktas, varav en allmän struktur för alla andra batterier kan beskrivas..
Batteri förstås som föreningen av två eller flera batterier, och de senare är voltaiska celler, vilket kommer att förklaras i ett framtida avsnitt..
Elektroder
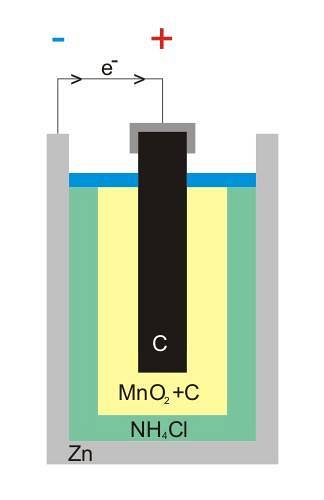
Den övre bilden visar den inre strukturen hos ett zink-kolbatteri. Oavsett vad den voltaiska cellen är bör det alltid (vanligtvis) finnas två elektroder: en från vilken elektroner avges och en annan som tar emot dem..
Elektroder är elektriskt ledande material, och för att det ska finnas ström måste båda ha olika elektronegativiteter.
Till exempel är zink, ett vitt burk som täcker batteriet, där elektronerna lämnar den elektriska kretsen (enheten) där den är ansluten.
Å andra sidan är den grafitiska kolelektroden i hela mediet; också nedsänkt i en pasta bestående av NH4Cl, ZnCltvå och MnOtvå.
Denna elektrod är den som tar emot elektronerna, och notera att den har symbolen '+', vilket betyder att den är den positiva polen på batteriet.
Terminaler
Som ses ovanför grafitstången i bilden finns den positiva elektriska terminalen; och nedan kan den inre zinkburken från vilken elektroner strömmar, den negativa terminalen.
Det är därför som batterierna har '+' eller '-' markeringar för att ange rätt sätt att ansluta dem till enheten och därmed låta den slå på..
Sand och vax
Även om det inte visas är pastan skyddad av en buffersand och en vaxtätning som hindrar den från att spillas eller komma i kontakt med stålet under mindre mekaniska stötar eller agitation..
Fungerar
Hur fungerar en torr cell? Till att börja med är det en voltaisk cell, det vill säga den genererar elektricitet från kemiska reaktioner. Därför förekommer redoxreaktioner inom celler där arten vinner eller tappar elektroner..
Elektroderna fungerar som en yta som underlättar och möjliggör utveckling av dessa reaktioner. Beroende på deras laddningar kan oxidation eller minskning av arten förekomma.
För att bättre förstå detta förklaras endast de kemiska aspekterna av zink-kolbatteriet..
Zinkelektrodoxidation
Så snart den elektroniska enheten slås på frigör batteriet elektroner genom att zinkelektroden oxideras. Detta kan representeras av följande kemiska ekvation:
Zn => Zntvå+ + 2e--
Om det finns mycket Zntvå+ omger metallen kommer en positiv laddningspolarisering att inträffa, så det kommer ingen ytterligare oxidation att ske. Därför är Zntvå+ måste diffundera genom pastan mot katoden, där elektronerna kommer in igen.
När elektronerna har aktiverat artefakten återgår de till den andra elektroden: grafiten, för att hitta några kemiska arter som "väntar" på den..
Ammoniumkloridreduktion
Som tidigare nämnts finns det NH i pasta4Cl och MnOtvå, ämnen som gör dess pH surt. Så snart elektronerna kommer in kommer följande reaktioner att inträffa:
2NH4+ + 2e- => 2NH3 + Htvå
De två produkterna, ammoniak och molekylärt väte, NH3 och Htvå, de är gaser och därför kan de "svälla" batteriet om de inte genomgår andra omvandlingar; såsom följande två:
Zntvå+ + 4NH3 => [Zn (NH3)4]två+
Htvå + 2MnOtvå => 2MnO (OH)
Observera att ammonium reducerades (fick elektroner) för att bli NH3. Dessa gaser neutraliserades sedan av de andra komponenterna i pastan..
Komplexet [Zn (NH3)4]två+ underlättar diffusionen av Zn-jonertvå+ mot katoden och på så sätt förhindra att batteriet "fastnar".
Artefaktens externa krets fungerar som en bro för elektronerna; annars skulle det aldrig finnas någon direkt koppling mellan zinkburken och grafitelektroden. I bilden av strukturen representerar denna krets den svarta kabeln.
Ladda ner
Torra celler finns i många varianter, storlekar och arbetsspänningar. Några av dem är inte uppladdningsbara (primära voltaiska celler), medan andra är (sekundära voltaiska celler).
Zink-kolbatteriet har en arbetsspänning på 1,5 V. Deras former förändras baserat på elektroderna och sammansättningen av elektrolyterna..
Det kommer en punkt där all elektrolyt har reagerat, och oavsett hur mycket zink oxideras kommer det inte finnas några arter som tar emot elektronerna och främjar deras frisättning..
Dessutom kan det vara fallet när de bildade gaserna inte längre neutraliseras och förblir utöva tryck inuti batterierna..
Zink-kolbatterier och andra batterier som inte är uppladdningsbara måste återvinnas; eftersom dess komponenter, särskilt nickelkadmiumkomponenter, är skadliga för miljön genom förorenande jord och vatten.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Batteriet "Dry-Cell". Återställd från: makahiki.kcc.hawaii.edu
- Hoffman S. (10 december 2014). Vad är ett torrcellsbatteri? Återställd från: upsbatterycenter.com
- Ogräs, Geoffrey. (24 april 2017). Hur fungerar torra batterier? Sciencing. Återställd från: sciencing.com
- Woodford, Chris. (2016) Batterier. Återställd från: explainthatstuff.com.



Ingen har kommenterat den här artikeln än.