
Kvävevalenskonfiguration och föreningar

De kvävevalenser De sträcker sig från -3, som i ammoniak och aminer, till +5 som i salpetersyra (Tyagi, 2009). Detta element expanderar inte valenser som andra.
Kväveatomen är ett kemiskt grundämne med atomnummer 7 och det första elementet i grupp 15 (tidigare VA) i det periodiska systemet. Gruppen består av kväve (N), fosfor (P), arsenik (As), antimon (Sb), vismut (Bi) och moscovium (Mc).

Elementen delar vissa allmänna likheter i kemiskt beteende, även om de tydligt skiljer sig från varandra kemiskt. Dessa likheter återspeglar vanliga egenskaper hos deras atoms elektroniska strukturer (Sanderson, 2016).
Kväve finns i nästan alla proteiner och spelar en viktig roll i både biokemiska och industriella applikationer. Kväve bildar starka bindningar på grund av dess förmåga att bilda en trippelbindning med en annan kväveatom och andra element..
Därför finns det en stor mängd energi i kväveföreningar. Före 100 år sedan var lite känt om kväve. Nu används ofta kväve för att konservera mat och som gödningsmedel (Wandell, 2016).
Elektronisk konfiguration och valenser
I en atom fyller elektronerna de olika nivåerna enligt deras energier. De första elektronerna fyller de lägre energinivåerna och flyttar sedan till en högre energinivå.
Den yttersta energinivån i en atom är känd som valensskal och elektronerna placerade i detta skal kallas valenselektroner..
Dessa elektroner finns främst i bindningsbildning och kemisk reaktion med andra atomer. Därför är valenselektroner ansvariga för olika kemiska och fysikaliska egenskaper hos ett element (Valence Electron, S.F.).
Kväve har, som nämnts tidigare, ett atomnummer på Z = 7. Detta innebär att dess fyllning av elektroner i deras energinivåer, eller elektronkonfiguration, är 1Stvå 2Stvå 2 s3.
Man måste komma ihåg att atomer i naturen alltid försöker ha den elektroniska konfigurationen av ädelgaser, antingen genom att vinna, förlora eller dela elektroner..
När det gäller kväve är ädelgasen som försöker ha en elektronisk konfiguration neon vars atomnummer är Z = 10 (1Stvå 2Stvå 2 s6) och helium, vars atomnummer är Z = 2 (1Stvå) (Reusch, 2013).
De olika sätten som kväve måste kombineras ger det sin valens (eller oxidationstillstånd). I det specifika fallet kväve, eftersom det befinner sig i periodens andra period, kan det inte expandera sitt valensskal som de andra elementen i sin grupp gör..
Det förväntas ha valenser på -3, +3 och +5. Kväve har dock valentillstånd från -3, som i ammoniak och aminer, till +5, som i salpetersyra. (Tyagi, 2009).
Valensbindningsteorin hjälper till att förklara bildandet av föreningar, enligt elektronkonfigurationen av kväve för ett givet oxidationstillstånd. För detta är det nödvändigt att ta hänsyn till antalet elektroner i valensskalet och hur mycket som finns kvar för att erhålla ädelgaskonfigurationen..
Kväveföreningar
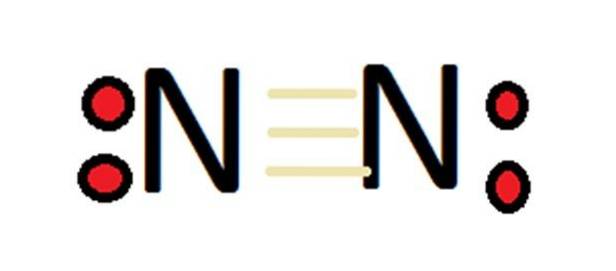
Med tanke på dess stora antal oxidationstillstånd kan kväve bilda ett stort antal föreningar. I första hand måste man komma ihåg att när det gäller molekylärt kväve är dess valens per definition 0.
Oxidationstillståndet -3 är ett av de vanligaste för grundämnet. Exempel på föreningar med detta oxidationstillstånd är ammoniak (NH3), aminer (R3N), ammoniumjon (NH4+iminer (C = N-R) och nitriler (C2N).
I oxidationstillståndet -2 kvarstår kväve med 7 elektroner i sitt valensskal. Detta udda antal elektroner i valensskalet förklarar varför föreningar med detta oxidationstillstånd har en överbryggande bindning mellan två kväve. Exempel på föreningar med detta oxidationstillstånd är hydraziner (Rtvå-N-N-Rtvåhydrazoner (C = N-N-Rtvå).
I -1-oxidationstillståndet lämnas kväve med 6 elektroner i valensskalet. Exempel på kväveföreningar med denna valens är hydroxylamin (RtvåNOH) och azoföreningarna (RN = NR).
I positiva oxidationstillstånd är kväve i allmänhet bunden till syreatomer för att bilda oxider, oxisalt eller oxisyror. För fallet med +1-oxidationstillståndet har kväve 4 elektroner i sitt valensskal.
Exempel på föreningar med denna valens är kväveoxid eller skrattgas (NtvåO) och nitrosoföreningar (R = NO) (Reusch, Oxidation States of Nitrogen, 2015).
När det gäller oxidationstillståndet +2 är ett exempel kväveoxid eller kväveoxid (NO), en färglös gas som produceras genom reaktion mellan metaller och utspädd salpetersyra. Denna förening är en extremt instabil fri radikal eftersom den reagerar med Otvå i luften för att bilda NO-gasentvå.
Nitrit (NOtvå-) i basisk lösning och salpetersyra (HNOtvå) i syralösning är exempel på föreningar med oxidationstillstånd +3. Dessa kan vara oxidationsmedel för att normalt producera NO (g) eller reduktionsmedel för att bilda nitratjonen..
Dinitrogen trioxide (NtvåELLER3och nitrogruppen (R-NOtvå) är andra exempel på kväveföreningar med valens +3.
Kväveoxid (NOtvå) eller kvävedioxid är en kväveförening med valens +4. Det är en brun gas som generellt produceras genom reaktion av koncentrerad salpetersyra med många metaller. Dimeriseras för att bilda NtvåELLER4.
I +5-tillståndet hittar vi nitrater och salpetersyra, som är oxidationsmedel i syralösningar. I det här fallet har kväve 2 elektroner i valensskalet, som är i 2S-omloppet. (Oxidationstillstånd för kväve, S.F.).
Det finns också föreningar såsom nitrosilazid och dinitrogen trioxide där kväve har olika oxidationstillstånd i molekylen. När det gäller nitrosilazid (N4O) kväve har en valens av -1, 0, + 1 och +2; och när det gäller dinitrogen trioxide har den valens +2 och +4.
Nomenklatur för kväveföreningar
Med tanke på komplexiteten i kväveföreningarnas kemi räckte inte den traditionella nomenklaturen för att namnge dem, och än mindre identifiera dem ordentligt. Det är därför bland annat att International Union of Pure and Applied Chemistry (IUPAC) skapade en systematisk nomenklatur där föreningar namnges enligt antalet atomer de innehåller..
Detta är fördelaktigt när det gäller namngivning av kväveoxider. Till exempel skulle kväveoxid benämnas kvävemonoxid och kväveoxid (NO) dinitrogenmonoxid (NtvåELLER).
Dessutom utvecklade den tyska kemisten Alfred Stock 1919 en metod för namngivning av kemiska föreningar baserade på oxidationstillståndet, som är skrivet med romerska siffror inom parentes. Således skulle till exempel kväveoxid och dikväveoxid kallas kväveoxid (II) respektive kväveoxid (I) (IUPAC, 2005).
Referenser
- (2005). NOMENKLATUR AV INORGANISK KEMI IUPAC-rekommendationer 2005. Återställd från iupac.org.
- Oxidationstillstånd för kväve. (S.F.). Återställd från kpu.ca.
- Reusch, W. (2013, 5 maj). Elektronkonfigurationer i det periodiska systemet. Återställd från chemistry.msu.edu.
- Reusch, W. (2015, 8 augusti). Kväveoxidationstillstånd. Återställd från chem.libretexts.org.
- Sanderson, R. T. (2016, 12 december). Kvävegruppselement. Återställd från britannica.com.
- Tyagi, V. P. (2009). Essential Chemistry XII. New Deli: Ratna Sagar.
- Valenselektroner. (S.F.). Återställd från chemistry.tutorvista.com.
- Wandell, A. (2016, 13 december). Kvävekemi. Återställd från chem.libretexts.org.


Ingen har kommenterat den här artikeln än.