
Potentiometer (pH-mätare) Vad det är för och hur det fungerar

A potentiometer är den anordning som används för att mäta potentialskillnaden mellan en fungerande och en referenselektrod, när båda är nedsänkta i en lösning av vilken det är önskvärt att bestämma dess surhet eller basitet, vilket uttrycker detta som pH.
På detta sätt avser potentiometri den analysmetod som används för att bestämma koncentrationen av H-joner.+ i ett ämne som är i lösning med hjälp av en potentiometer och de två ovannämnda elektroderna.

När det gäller referenselektroden har den en känd, konstant och stabil potential till skillnad från arbetselektroden. Potentialen som utvecklas i denna sista elektrod varierar i proportion till koncentrationen av H-joner+ som finns i lösningen.
Denna potential påverkas också i hög grad av temperaturen vid vilken mätningen utförs..
Artikelindex
- 1 Vad är det för?
- 2 Hur fungerar det??
- 2.1 Elektroder
- 2.2 Kalibrering av en potentiometer
- 3 Referenser
Vad är det för?
Det finns ett stort antal processer som utförs inom det industriella området - såsom läkemedelsproduktion, livsmedelsbearbetning och vattenrening - som är mycket känsliga för variationer i pH-nivåer. Av denna anledning är dess korrekta mätning så viktigt.
Som tidigare nämnts är pH en parameter som används för att mäta surheten eller alkaliniteten hos en lösning som är i vattenfasen genom att analysera koncentrationen av H-joner.+ i lösning. Därefter beräknas pH-värdet med följande ekvation:
pH = -log [H+]
Så potentiometern används för att mäta pH för ett ämne i lösning..
När potentiometern är ansluten till de två elektroderna nedsänkta i lösningen som ska analyseras detekterar den potentialskillnaden mellan arbetselektroden och referenselektroden, förstärker denna signal och omvandlar den till ett pH-värde med hjälp av ekvationen som beskrivs ovan..
Hur fungerar det?
Driften av en potentiometer är baserad på mekanismen för en elektrokemisk cell, där H-joner är inblandade+ i cellens kemiska reaktion för att bestämma koncentrationen av dessa joner i lösningen och på detta sätt erhålla pH för samma.
När det är önskvärt att mäta pH i en lösning genom potentiometri används en potentiometer och en elektrod; den första är anordningen som bestämmer pH, medan den andra är baserad på kombinationen av en referenselektrod och en mätelektrod som är känslig för analyter.
I denna mening bildas en krets genom vilken den elektriska strömmen flyter mellan elektroderna och lösningen, där de utför funktionen av ett batteri när de är nedsänkta i nämnda lösning..
På detta sätt är potentiometern utformad för att generera en spänning lika med noll (i enheter av millivolt) när den har ett pH lika med sju; det vill säga neutral.
På samma sätt, när en ökning av potentiella värden registreras (med positiva siffror) betyder det att det finns lägre pH-värden, och när en minskning observeras - det vill säga en tillväxt mot negativa tal - vi talar om högre värden..
Elektroder
Mätelektroden består av en anordning där reaktionen som studeras (oxidation eller reduktion) äger rum.
Även om det finns många typer är det i allmänhet glas som består av ett mycket tunt glasmembran som har permeabilitet för H-joner.+ av den miljö det är i.
Genom att placera detta i en lösning som har ett pH som skiljer sig från lösningen i cellen genereras en potentialskillnad mellan de två ytorna på membranet och denna skillnad kan registreras med hjälp av en referenselektrod..
Å andra sidan är referenselektroden en anordning som har egenskaper med stabil potential och med ett känt värde, som normalt används som anod i den elektrokemiska cellen..
Ett exempel på denna typ av elektrod är en som består av en silvertråd, som är belagd med silverklorid och nedsänkt i en utspädd saltsyralösning, eller referenselektroden mättad med kalomel, som den som visas i figuren nedan.
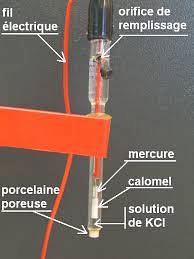
Så potentiometern bestämmer potentialskillnaden som genereras mellan elektroderna, även om endast arbetselektrodens potential beror på koncentrationerna av den joniska arten..
Kalibrera en potentiometer
Kalibreringen av en potentiometer måste utföras genom kända buffertlösningar (även kallade buffertar eller buffertlösningar), som består av system med praktiskt taget oföränderligt pH som innehåller en svag substans och dess konjugerade art..
Varje buffert har ett specifikt pH, som kan vara surt (pH<7), básico (pH>7) eller neutralt (pH = 7) och kan köpas redan standardiserat eller beredas i laboratoriet med certifierade reagens och med etablerade och validerade procedurer..
Eftersom potentiometrar mäter pH-värdet inom ett område som anses vara brett, måste det vara känt om analyten har ett pH som är högre eller mindre än sju för att fortsätta med sin korrekta kalibrering..
Således, för prover vars pH förväntas vara basiskt, bör det kalibreras med en buffertlösning med ett pH lika med sju och ett annat med ett högre pH (normalt används ett av pH tio)..
Å andra sidan, för prover med ett förväntat surt pH, kalibreras det med en buffertlösning med ett pH lika med sju och en annan med ett lägre pH (normalt används ett pH fyra)..
Slutligen måste omkalibreringen av detta mätinstrument utföras före och efter varje användning, där dess resultat registreras, inklusive datum och tid då de genomfördes och egenskaperna hos buffertlösningarna som används för att kontrollera det..
Referenser
- Wikipedia. (s.f.). PH-mätare. Erhålls från es.wikipedia.org
- Chang, R. (2007). Chemistry, nionde upplagan. (McGraw-Hill).
- Westcott, C. (2012). Ph-mätningar. Erhålls från books.google.co.ve
- Nielsen, C. (1996). Hantera Analytical Laboratory: Plain and Simple. Erhålls från books.google.co.ve
- Kenkel, J. (2010). Analytisk kemi för tekniker, tredje upplagan. Erhålls från books.google.co.ve
- Cable, M. (2005). Kalibrering: En teknikerhandbok. Erhålls från books.google.co.ve



Ingen har kommenterat den här artikeln än.