
Elementens periodiska egenskaper och deras egenskaper

De Elementens periodiska egenskaper är de som definierar deras fysiska och kemiska beteende ur ett atomperspektiv, och vars magnituder, förutom atomnummer, tillåter en klassificering av atomer.
Av alla egenskaper karakteriseras dessa, som namnet antyder, för att vara periodiska; det vill säga om det periodiska systemet studeras kommer det att vara möjligt att intyga att dess storleksordning följer en trend som sammanfaller och upprepas med ordningen av elementen i perioder (rader) och grupper (kolumner).

Till exempel, om en period passeras och en periodisk egenskap minskar i storlek för varje element, kommer samma att hända med den i alla perioder. Å andra sidan, om man går ner i en grupp eller kolumn ökar dess storlek, kan samma förväntas hända för de andra grupperna..
Och så upprepas dess variationer och visar en enkel tendens som överensstämmer med ordningen av elementen efter deras atomnummer. Dessa egenskaper är direkt ansvariga för elementens metalliska eller icke-metalliska karaktär, liksom deras reaktiviteter, vilket har hjälpt till att klassificera dem i mer djup..
Om elementens identitet för ett ögonblick var okänd och de sågs som konstiga "sfärer", kunde det periodiska systemet byggas om (med mycket arbete) med användning av dessa egenskaper.
På detta sätt skulle de antagna sfärerna förvärva färger som gör det möjligt att skilja dem från varandra i grupper (övre bild). Att känna till deras elektroniska egenskaper, de kunde organiseras i perioder, och grupperna skulle avslöja de som har samma antal valenselektroner.
Att lära sig och resonera om periodiska egenskaper är detsamma som att veta varför element reagerar på ett eller annat sätt; är att veta varför metallelement finns i vissa regioner i tabellen och icke-metalliska element i ett annat.
Artikelindex
- 1 Vilka är de periodiska egenskaperna och deras egenskaper?
- 1.1 -Atomradie
- 1.2 -Elektronegativitet
- 1.3 -Metallkaraktär
- 1.4 -Ioniseringsenergi
- 1.5 -Elektronisk affinitet
- 2 Referenser
Vilka är de periodiska egenskaperna och deras egenskaper
-Atomradio
När du observerar sfärerna i bilden är det första som kan märkas att de inte är lika stora. Vissa är större än andra. Om du tittar närmare kommer du att upptäcka att dessa storlekar varierar beroende på ett mönster: under en period minskar den från vänster till höger och i en grupp ökar den från topp till botten..
Ovanstående kan också sägas så här: Atomradien minskar mot grupperna eller kolumnerna till höger och ökar under de lägre perioderna eller raderna. I detta fall är atomradien den första periodiska egenskapen, eftersom dess variationer följer ett mönster inom elementen..
Kärnladdning mot elektroner
Varför detta mönster? Under en period upptar atomens elektroner samma energinivå, vilket är relaterat till avståndet som skiljer dem från kärnan. När vi går från en grupp till en annan (vilket är detsamma som att gå igenom perioden till höger) lägger kärnan till både elektroner och protoner inom samma energinivå..
Därför kan elektronerna inte uppta ytterligare avstånd från kärnan, vilket ökar dess positiva laddning eftersom den har fler protoner. Följaktligen upplever elektronerna en större attraktionskraft mot kärnan och attraherar dem mer och mer när antalet protoner ökar..
Det är därför elementen längst till höger i det periodiska systemet (gula och turkosa kolumner) har de minsta atomeradierna..
Å andra sidan, när du "hoppar" från en period till en annan (vilket är detsamma som att säga att du går ner en grupp), möjliggjorde de nya energinivåerna elektronerna att uppta mer avlägsna utrymmen från kärnan. När man är längre bort, lockar kärnan (med fler protoner) dem med mindre kraft; och atomradierna ökar därför.
Joniska radier
Joniska radier följer ett liknande mönster som atomradier; Dessa beror dock inte så mycket på kärnan, utan på hur många eller färre elektroner atomen har med avseende på dess neutrala tillstånd.
Katjonerna (Na+, ACtvå+, Till3+, Varatvå+, Tro3+) uppvisar en positiv laddning eftersom de har tappat en eller flera elektroner, och därför lockar kärnan dem med större kraft eftersom det finns färre avstötningar mellan dem. Resultatet: katjoner är mindre än de atomer som de härrör från.
Och för anjonerna (Otvå-, F-, Stvå-, Jag-tvärtom uppvisar de negativ laddning eftersom de har en eller flera elektroner i överskott, vilket ökar deras avstötningar mot varandra över den attraktion som kärnan utövar. Resultatet: anjonerna är större än de atomer som de härrör från (bilden nedan).
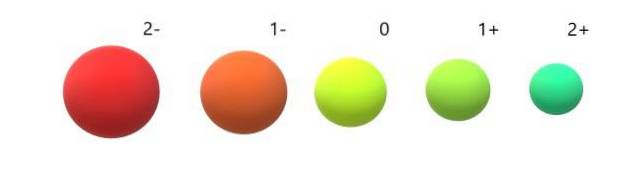
Det inses att 2- anjonen är den mest omfattande av alla, och 2+ katjonen den minsta. Radierna ökar när atomen är negativt laddad och kontraherar när den är positivt laddad..
-Elektronnegativitet
När element har små atomeradier, lockas inte bara deras elektroner mycket starkt, utan också elektroner från närliggande atomer när de bildar en kemisk bindning. Denna tendens att locka elektroner från andra atomer i en förening är känd som elektronegativitet..
Bara för att en atom är liten betyder det inte att den blir mer elektronegativ. Om så är fallet skulle elementen helium och väte vara de mest elektronegativa atomerna. Helium bildar, såvitt vetenskapen har visat, inte någon kovalent bindning av något slag; och väte, har bara en enda proton i kärnan.
När atomradierna är stora har kärnorna inte tillräckligt med kraft för att attrahera elektroner från andra atomer; därför är de mest elektronegativa elementen de med en liten atomradie och ett större antal protoner.
Återigen är de som uppfyller dessa egenskaper perfekt de icke-metalliska elementen i p-blocket i det periodiska systemet; Dessa är de som tillhör grupp 16 eller syre (O, S, Se, Te, Po) och grupp 17 eller fluor (F, Cl, Br, I, At).
Trend
Enligt allt som har sagts finns de mest elektronegativa elementen speciellt i det övre högra hörnet av det periodiska systemet; med fluor som det element som leder listan över de mest elektronegativa.
Varför? Utan att tillgripa elektronegativitetsskalor (Pauling, Mulliken, etc.), även om fluor är större än neon (dess ädelgas), kan den förra bilda bindningar medan den senare inte kan. Dessutom, för sin lilla storlek, har dess kärna många protoner, och där fluor finns kommer det att finnas ett dipolmoment.
-Metallisk karaktär
Om ett element har en atomradie jämfört med dem under samma period och inte heller är särskilt elektronegativ, är det en metall och har en hög metallisk karaktär.
Om vi går tillbaka till huvudbilden motsvarar de rödaktiga och grönaktiga sfärerna, liksom de gråaktiga, metalliska element. Metaller har unika egenskaper, och härifrån börjar de periodiska egenskaperna sammanflätas med materiens fysikaliska och makroskopiska egenskaper..
Element med hög metallisk karaktär kännetecknas av sina relativt stora atomer, lätt att förlora elektroner eftersom kärnorna knappast kan locka dem till dem..
Som ett resultat oxideras de lätt eller förloras elektroner för att bilda katjoner, M+; detta betyder inte att alla katjoner är metalliska.
Trend
Vid denna tidpunkt kan du förutsäga hur den metalliska karaktären varierar i det periodiska systemet. Om det är känt att metaller har stora metallradier och att de också är få elektronegativa, bör det förväntas att de tyngsta elementen (de lägre perioderna) är de mest metalliska; och de lättaste elementen (de övre perioderna), desto mindre metalliska.
Dessutom minskar metallkaraktären ju mer elektronegativt elementet blir. Detta innebär att genom att gå igenom perioderna och grupperna till höger om det periodiska systemet, i deras övre perioder, kommer de att hitta de mindre metalliska elementen..
Därför ökar den metalliska karaktären nedåt genom en grupp och minskar från vänster till höger under samma period. Bland de metalliska elementen har vi: Na (natrium), Li (litium), Mg (magnesium), Ba (barium), Ag (silver), Au (guld), Po (polonium), Pb (bly), Cd (kadmium ), Al (aluminium), etc..
-Joniseringsenergi
Om en atom har en stor atomradie, kan det förväntas att dess kärna inte kommer att hålla elektroner i de yttersta skalen fångade med avsevärd kraft. Följaktligen kommer det inte att kräva mycket energi att ta bort dem från atomen i gasfasen (individualiserad); det vill säga joniseringsenergin, EI, som behövs för att ta bort en elektron från dem.
EI motsvarar också att det är energin som måste tillföras för att övervinna den attraktiva kraften hos kärnan hos en atom eller gasjon på dess yttersta elektron. Ju mindre atomen och ju mer elektronegativ, desto lägre är dess EI; det här är din trend.
Följande ekvation illustrerar ett exempel:
Na (g) => Na+(g) + e-
EI som behövs för att uppnå detta är inte så bra jämfört med den andra joniseringen:
Na+(g) => Natvå+(g) + e-
Sedan i Na+ positiva laddningar dominerar och jonen är mindre än den neutrala atomen. Följaktligen kärnan av Na+ drar elektroner med en mycket större kraft, vilket kräver en mycket större EI.
-Elektronisk samhörighet
Och slutligen finns det den periodiska egenskapen hos elektronisk affinitet. Detta är den energiska tendensen hos atomen hos ett element i gasfasen att acceptera en elektron. Om atomen är liten och har en kärna med en stor attraktionskraft blir det lätt för den att acceptera elektronen och bilda en stabil anjon..
Ju mer stabil anjonen är med avseende på dess neutrala atom, desto större är dess elektronaffinitet. Men avstötningar mellan elektronerna själva spelar också in.
Kväve har till exempel en högre elektronaffinitet än syre. Detta beror på att dess tre 2p-elektroner är oparade och stöter bort varandra och den inkommande elektronen mindre; medan det är syre finns det ett par parade elektroner som utövar större elektronisk avstötning; och i fluor finns det två par.
Det är av denna anledning som trenden i elektroniska affiniteter sägs normalisera från den tredje perioden i det periodiska systemet..
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Prof. Ortega Graciela M. (1 april 2014). Elementens periodiska egenskaper. Färg abc. Återställd från: abc.com.py
- Kemi LibreTexts. (7 juni 2017). Elementens periodiska egenskaper. Återställd från: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (02 januari 2019). Elementens periodiska egenskaper. Återställd från: thoughtco.com
- Toppr. (s.f.). Elementens periodiska egenskaper. Återställd från: toppr.com /
- Elementens periodiska egenskaper: En resa över bordet är en resa genom kemi. [PDF]. Återställd från: cod.edu


Ingen har kommenterat den här artikeln än.