
Vad är utsläppsspektrumet? (Med exempel)

De utsläppsspektrum är spektrumet av våglängder av ljus som emitteras av atomer och molekyler vid övergång mellan två energitillstånd. Vitt ljus eller synligt ljus som slår ett prisma bryts ner i olika färger med specifika våglängder för varje färg. Mönstret av färger som erhålls är det synliga strålningsspektrumet för ljus som kallas emissionsspektrum.
Atomer, molekyler och ämnen har också ett utsläppsspektrum på grund av utsläpp av ljus när de absorberar lämplig mängd energi från utsidan till transitering mellan två energitillstånd. Genom att föra detta ljus genom ett prisma bryts det ner i spektralfärgade linjer med olika våglängder för varje element..
Vikten av utsläppsspektrumet är att det gör det möjligt att bestämma sammansättningen av okända ämnen och astronomiska föremål genom analys av deras spektrallinjer med hjälp av emissionsspektroskopitekniker..
Därefter förklaras vad utsläppsspektret består av och hur det tolkas, några exempel nämns och skillnaderna som finns mellan utsläpps- och absorptionsspektrumet.
Artikelindex
- 1 Vad är ett emissionsspektrum?
- 2 Tolkning av utsläppsspektrumet
- 3 Skillnad mellan emissionsspektrum och absorptionsspektrum.
- 4 Exempel på utsläppsspektra av kemiska element
- 5 Referenser
Vad är ett utsläppsspektrum?
Atomerna i ett element eller ett ämne har elektroner och protoner som hålls samman tack vare den elektromagnetiska attraktionskraften. Enligt Bohr-modellen är elektronerna ordnade på ett sådant sätt att atomens energi är lägst möjligt. Denna energinivå kallas atomens grundtillstånd..
När atomerna förvärvar energi från utsidan rör sig elektronerna mot en högre energinivå och atomen ändrar sitt marktillstånd till ett upphetsat tillstånd..
I det exciterade tillståndet är elektronens uppehållstid mycket liten (≈ 10-8 s) (1), atomen är instabil och återgår till marktillståndet och passerar, om nödvändigt, genom mellanliggande energinivåer.
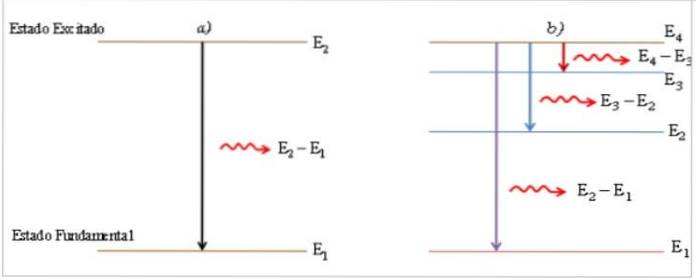
Vid övergångsprocessen från ett exciterat tillstånd till ett jordtillstånd avger atomen en ljusfoton med energi lika med energidifferensen mellan de två tillstånden, som är direkt proportionell mot frekvensen v och omvänt proportionell mot dess våglängd λ.
Den emitterade foton visas som en ljus linje, kallad spektrallinjen (2), och den spektrala energifördelningen för samlingen av emitterade fotoner vid atomens övergångar är emissionsspektrumet.
Tolkning av utsläppsspektrumet
Vissa av atomens övergångar orsakas av en temperaturökning eller av närvaron av andra externa energikällor såsom en ljusstråle, en elektronström eller en kemisk reaktion..
Om en gas som väte placeras i en kammare vid lågt tryck och en elektrisk ström passerar genom kammaren, kommer gasen att avge ett ljus med sin egen färg som skiljer den från andra gaser..
Genom att leda det utsända ljuset genom ett prisma, istället för att få en ljusbåge, erhålls diskreta enheter i form av färgade linjer med specifika våglängder, som bär diskreta mängder energi.
Utsläppsspektrumslinjerna är unika i varje element och deras användning från spektroskopitekniken gör det möjligt att bestämma den elementära sammansättningen av en okänd substans såväl som sammansättningen av astronomiska föremål genom att analysera våglängderna för de emitterade fotonerna under atomens övergång..
Skillnad mellan emissionsspektrum och absorptionsspektrum.
I processerna för absorption och emission har atomen övergångar mellan två energitillstånd, men det är i absorptionen att den får energi från utsidan och når tillståndet av excitation..
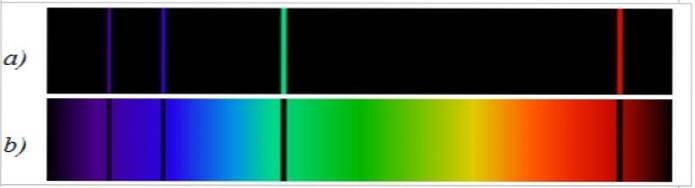
Den spektrala utsläppslinjen är motsatt det kontinuerliga spektrumet av vitt ljus. I den första observeras spektralfördelningen i form av ljusa linjer och i den andra observeras ett kontinuerligt färgband..
Om en stråle av vitt ljus träffar en gas som väte, innesluten i en kammare vid lågt tryck, kommer endast en del av ljuset att absorberas av gasen och resten kommer att överföras.
När det överförda ljuset passerar genom ett prisma bryts det ner i spektrala linjer, var och en med olika våglängd, vilket bildar gasens absorptionsspektrum..
Absorptionsspektrumet är helt motsatt till emissionsspektrumet och det är också specifikt för varje element. Vid jämförelse av båda spektra av samma element, observeras att emissionsspektrallinjerna är de som saknas i absorptionsspektrumet (figur 2).
Exempel på utsläppsspektra av kemiska element
a) Väteatomens spektrala linjer, i det synliga området av spektrumet, är en röd linje på 656,3 nm, en ljusblå på 486,1 nm, en mörkblå på 434 nm och en mycket svag violett på 410 nm. Dessa våglängder erhålls från ekvationen Balmer - Rydberg i sin moderna version (3).
är spektrumlinjens vågnummer
är Rydbergs konstant (109666,56 cm-1)
är den högsta energinivån
är den högsta energinivån

b) Heliumets emissionsspektrum har två serier av huvudlinjer, en i det synliga området och den andra nära ultraviolett. Peterson (4) använde Bohr-modellen för att beräkna en serie heliumemissionslinjer i den synliga delen av spektrumet, som ett resultat av flera samtidiga övergångar av två elektroner till n = 5-tillståndet och erhöll värden för den våglängd som var konsekvent med experimentella resultat. Våglängderna som erhölls är 468,8 nm, 450,1 nm, 426,3 nm, 418,4 nm, 412,2 nm, 371,9 nm.
c) Utsläppsspektrumet för natrium har två mycket ljusa linjer på 589 nm och 589,6 nm kallade D-linjer (5). De andra linjerna är mycket svagare än dessa och för praktiska ändamål anses allt natriumljus komma från D-linjerna..
Referenser
- Mätning av livstiderna för väteatomens exciterade tillstånd. V. A. Ankudinov, S. V. Bobashev och E. P. Andreev. 1, 1965, Soviet Physics JETP, Vol. 21, pp. 26-32.
- Demtröder, W. Laserspektroskopi 1. Kaiserslautern: Springer, 2014.
- D.K. Rai, S.N Thakur och. Atom, laser och spektroskopi. New Delhi: Phi Learning, 2010.
- Bohr Revisited: Modell och spektrala linjer av helium. Peterson, C. 5, 2016, Journal of young investigators, Vol. 30, pp. 32-35.
- Journal of chemical Education. J.R. Appling, F. J. Yonke, R. A. Edgington och S. Jacobs. 3, 1993, Vol. 70, sid. 250-251.

Ingen har kommenterat den här artikeln än.