
Dubbel substitution reaktionstyper och exempel

De dubbel substitutionsreaktion, dubbel förskjutning eller metates, är en i vilken ett dubbeljonbyte sker mellan två föreningar, utan att någon av dessa oxideras eller reduceras. Det utgör en av de mest elementära kemiska reaktionerna.
De nya bindningarna bildas av de stora elektrostatiska attraktionskrafterna mellan jonerna. På samma sätt gynnar reaktionen bildandet av de mest stabila arterna, främst vattenmolekylen. Bilden nedan illustrerar den allmänna kemiska ekvationen för dubbel substitutionsreaktion..
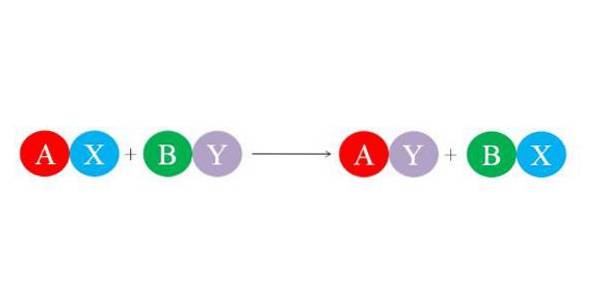
De initiala föreningarna AX och BY reagerar genom att utbyta "sina partners" och bildar sålunda två nya föreningar: AY och BX. Denna reaktion inträffar om och endast om A och Y är mer relaterade än A och B, eller om BX-bindningarna är mer stabila än för BY. Eftersom reaktionen är ett enkelt jonbyte, varken jon vinner eller förlorar elektroner (redoxreaktion).
Således, om A är en katjon med +1 laddning i förening AX, kommer den att ha samma +1 laddning i förening AY. Detsamma gäller resten av "bokstäverna". Denna typ av reaktion är stöd för syrabasreaktioner och bildning av fällningar..
Artikelindex
- 1 Typer
- 1.1 Neutralisering
- 1.2 Nederbörd
- 2 Exempel
- 2.1 Exempel 1
- 2.2 Exempel 2
- 2.3 Exempel 3
- 2.4 Exempel 4
- 2.5 Exempel 5
- 2.6 Exempel 6
- 2.7 Exempel 7
- 2.8 Exempel 8
- 3 Referenser
Typer
Neutralisering
En stark syra reagerar med en stark bas för att producera lösliga salter och vatten. När en av de två - syran eller basen - är svag, är det producerade saltet inte helt joniserat; i ett vattenhaltigt medium som kan hydrolysera. På liknande sätt kan syran eller basen neutraliseras med ett salt..
Ovanstående kan återigen representeras av den kemiska ekvationen med bokstäverna AXBY. Eftersom Brønsted surhet endast indikeras av H-joner+ och OH-, Dessa representerar sedan bokstäverna A och Y:
HX + BOH => HOH + BX
Denna kemiska ekvation motsvarar neutralisering, vilket helt enkelt är reaktionen mellan en HX-syra och en BOH-bas för att producera HOH (HtvåO) och BX-saltet, som kan eller inte kan vara lösligt i vatten.
Dess skelett kan variera beroende på de stökiometriska koefficienterna eller syran (om den är organisk eller oorganisk).
Nederbörd
Vid denna typ av reaktion är en av produkterna olöslig i mediet, i allmänhet vattenhaltig och fälls ut (det fasta ämnet sedimenterar från resten av lösningen).
Schemat är som följer: två lösliga föreningar, AX och BY, blandas och en av produkterna, AY eller BX, fälls ut, vilket beror på löslighetsreglerna:
AX + BY => AY (s) + BX
AX + BY => AY + BX (s)
I händelse av att både AY och BX är olösliga i vatten kommer paret joner som presenterar de starkaste elektrostatiska interaktionerna att utfällas, vilket kan återspeglas kvantitativt i deras värden av löslighetskonstanter (Kps).
I de flesta utfällningsreaktioner är emellertid ett salt lösligt och det andra fälls ut. Båda reaktionerna - neutralisering och nederbörd - kan förekomma i samma blandning av ämnen.
Exempel
Exempel 1
HCl (aq) + NaOH (aq) => HtvåO (l) + NaCl (aq)
Vilken typ av reaktion är det här? Saltsyra reagerar med natriumhydroxid, vilket resulterar i vatten och natriumklorid. På grund av det faktum att NaCl är mycket lösligt i vattenhaltigt medium och att en vattenmolekyl också bildades, är reaktionen i exempel 1 neutralisering.
Exempel 2
Stämpel3)två(ac) + NatvåS (ac) => CuS (s) + 2NaNO3(ac)
Varken H-jon är närvarande i denna reaktion+ inte heller OH-, och inte heller observeras vattenmolekylen på den högra sidan av den kemiska ekvationen.
Koppar (II) nitrat, eller koppar nitrat, utbyter joner med natriumsulfid. Kopparsulfid är olöslig, fälls ut till skillnad från natriumnitrat, lösligt salt.
Cu-lösningen (NO3)två är blåaktig, medan NatvåS är gulaktig. När båda är blandade försvinner färgerna och CuS fälls ut, vilket är ett svartaktigt fast ämne..
Exempel 3
CH3COOH (aq) + NaOH (aq) => CH3COONa (ac) + HtvåO (l)
Återigen är detta en annan neutraliseringsreaktion. Ättiksyra reagerar med natriumhydroxid för att bilda natriumacetatsaltet och en vattenmolekyl.
Till skillnad från exempel 1 är natriumacetat inte ett salt som är helt joniserat, eftersom anjonen hydrolyseras:
CH3KUTTRA-(ac) + HtvåO (l) <=> CH3COOH (aq) + OH-(ac)
Exempel 4
2HI (ac) + CaCO3(s) => HtvåCO3(ac) + CaItvå(ac)
I denna reaktion - som även om det inte verkar vara neutralisering - reagerar hydrojodsyran fullständigt med kalkstenen för att generera kolsyra och kalciumjodid. Vidare sönderfaller värmeutvecklingen (exoterm reaktion) kolsyra i koldioxid och vatten:
HtvåCO3(ac) => COtvå(g) + HtvåO (l)
Den totala reaktionen är som:
2HI (ac) + CaCO3(s) => COtvå(g) + HtvåO (l) + CaItvå(ac)
På samma sätt neutraliserar kalciumkarbonat, ett basiskt salt, hydrojodsyra.
Exempel 5
AgNO3(aq) + NaCl (aq) => AgCl (s) + NaNO3(ac)
Silvernitrat utbyter joner med natriumklorid, vilket bildar det olösliga saltet silverklorid (vit fällning) och natriumnitrat..
Exempel 6
2H3PO4(ac) + 3Ca (OH)två(ac) => 6HtvåO (l) + Ca3(PO4)två(s)
Fosforsyra neutraliseras av kalciumhydroxid och bildar följaktligen det olösliga saltet kalciumfosfat och sex mol vattenmolekyler..
Detta är ett exempel på en dubbel substitutionsreaktion av båda typerna: neutralisering av syran och utfällning av ett olösligt salt..
Exempel 7
KtvåS (ac) + MgSO4(ac) => KtvåSW4(ac) + MgS (s)
Kaliumsulfid reagerar med magnesiumsulfat och samlar S-jonerna i lösningtvå- och Mgtvå+ för att bilda det olösliga saltet av magnesiumsulfid och det lösliga saltet av kaliumsulfat.
Exempel 8
NatvåS (aq) + HCl (aq) → NaCl (aq) + HtvåS (g)
Natriumsulfid neutraliserar saltsyra och genererar natriumklorid och vätesulfid.
I denna reaktion bildas inte vatten (till skillnad från de vanligaste neutraliseringarna) utan den icke-elektrolytiska molekylen vätesulfid, vars lukt av ruttna ägg är mycket obehaglig. HtvåS flyr från lösningen i gasform och resten av arten förblir upplöst.
Referenser
- Whitten, Davis, Peck & Stanley. Kemi. (8: e upplagan). CENGAGE Learning, s 150-155.
- Quimicas.net (2018). Exempel på dubbel substitutionsreaktion. Hämtad 28 maj 2018 från: quimicas.net
- Metatesreaktioner. Hämtad den 28 maj 2018 från: science.uwaterloo.ca
- Khan akademin. (2018). Dubbla ersättningsreaktioner. Hämtad den 28 maj 2018 från: khanacademy.org
- Helmenstine, Anne Marie, Ph.D. (8 maj 2016). Definition av dubbel ersättningsreaktion. Hämtad den 28 maj 2018 från: thoughtco.com


Ingen har kommenterat den här artikeln än.