
Enkla, dubbla förskjutningsreaktioner och exempel
De förskjutningsreaktioner är alla de där en kemisk art förskjuter en annan inom en förening. Denna förskjutning kan vara enkel eller dubbel, skiljer sig åt genom att i den första är det ett element som förskjuts, medan det i det andra sker en förändring av "par" mellan två föreningar..
Dessa typer av reaktioner är endast möjliga under vissa förhållanden: en av arterna måste ha ett oxidationsnummer på noll eller alla måste nödvändigtvis joniseras. Vad betyder ett oxidationsnummer på noll? Det betyder att arten är i sitt naturliga tillstånd.

Ett mycket illustrativt exempel på ovanstående tillvägagångssätt är reaktionen mellan en koppartråd och en silvernitratlösning. Eftersom koppar är en metall i sitt naturliga tillstånd är dess oxidationsnummer noll; å andra sidan är den för silver +1 (Ag+), som ligger upplöst tillsammans med nitratjoner (NO3-).
Metaller ger upp elektroner, men vissa är mer aktiva än andra; Det betyder att inte alla metaller rostar så lätt. Eftersom koppar är mer aktiv än silver donerar den sina elektroner och reducerar den till dess naturliga tillstånd, reflekterad som en silveryta som täcker koppartråden (bilden ovan).
Artikelindex
- 1 Förskjutningsreaktioner
- 1.1 Enkelt
- 1.2 Dubbel
- 2 Exempel
- 2.1 Enkelt
- 2.2 Dubbel
- 3 Referenser
Förskjutningsreaktioner
Enkel
Förskjutning av väte och metaller
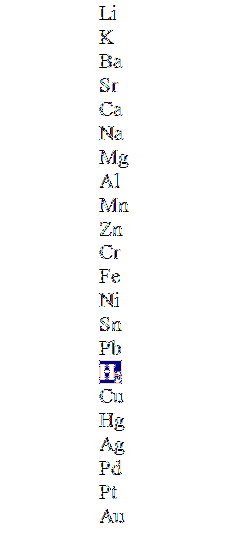
Den övre bilden visar en kolumn i minskande ordningsföljd och markerar vätemolekylen. De metaller som ligger ovanför detta kan förskjuta den i de icke-oxiderande syrorna (HCl, HF, HtvåSW4, etc.), och de nedan kommer inte att reagera alls.
Den enkla förskjutningsreaktionen kan beskrivas med följande allmänna ekvation:
A + BC => AB + C.
A förskjuter C, som kan vara H-molekylentvå eller annan metall. Ja Htvå bildas av reduktionen av H-joner+ (2H+ + 2e- => Htvå), då måste A A - på grund av bevarande av massa och energi - tillhandahålla elektronerna: det måste oxideras.
Å andra sidan, om A och C är metalliska arter, men C är i jonform (M+) och A i sitt naturliga tillstånd, då kommer förskjutningsreaktionen endast att ske om A är mer aktiv än C, vilket tvingar den senare att acceptera elektroner för att reducera till dess metalliska tillstånd (M).
Förskjutning med halogener
På samma sätt kan halogener (F, Cl, Br, I, At) röra sig med varandra men följa en annan serie aktiviteter. För dessa minskar aktiviteten när man går ner genom grupp 7A (eller 17): I Till exempel sker följande reaktion naturligt: Ftvå(g) + 2Nal (ac) => 2NaF (ac) + Itvå(s) Denna andra producerar dock inga produkter av de just förklarade skälen: Jagtvå(s) + NaF (ac) => X I ovanstående ekvation betyder X att det inte finns någon reaktion. Med denna kunskap kan man förutsäga vilken blandning av halogensalter och de rena elementen som producerar produkter. Som en tumregel förskjuter jod (ett flyktigt lila fast ämne) inte någon av de andra halogenerna, men de andra förskjuter det när det är i jonform (Na+ Jag-). Dubbelförskjutningsreaktionen, även känd som metatesreaktionen, representeras enligt följande: AB + CD => AD + CB Den här gången förskjuter inte bara A C utan även B förskjuter D. Denna typ av förskjutning sker endast när lösningar av lösliga salter blandas och en fällning bildas; dvs. AD eller CB måste vara olösliga och ha starka elektrostatiska interaktioner. Till exempel när man blandar KBr- och AgNO-lösningar3, de fyra jonerna rör sig genom mediet tills de bildar motsvarande par av ekvationen: KBr (ac) + AgNO3(ac) => AgBr (s) + KNO3(ac) Agjoner+ och Br- bilda silverbromidfällningen, medan K+ och nej3- kan inte arrangeras för att bilda en kristall av kaliumnitrat. När en syra neutraliseras med en bas inträffar en dubbelförskjutningsreaktion: HCl (aq) + NaOH (aq) => NaCl (aq) + HtvåO (l) Här bildas ingen fällning, eftersom natriumklorid är ett mycket lösligt salt i vatten, men en pH-förändring inträffar, som justerar sig till ett värde nära 7. I följande reaktion inträffar emellertid en förändring av pH och bildandet av en fällning samtidigt: H3PO4(ac) + 3Ca (OH)två => Ca3(PO4)två(s) + 3HtvåO (l) Kalciumfosfat är olösligt och fälls ut som ett vitt fast ämne medan fosforsyra neutraliseras med kalciumhydroxid.. Cu (s) + 2AgNO3(ac) => Cu (NO3)två(ac) + 2Ag (s) Det här är koppartrådens bildreaktion. Om du tittar på serien av kemiska aktiviteter för metaller kommer du att upptäcka att koppar är över silver, så att det kan förskjuta det. Zn (s) + CuSO4(ac) => ZnSO4(ac) + Cu (s) Med denna andra reaktion inträffar det motsatta: nu den blåaktiga lösningen av CuSO4 blir transparent när koppar fälls ut som metall och samtidigt sönderfaller metalliskt zink till lösligt zinksulfatsalt. 2Al (s) + 3NiBrtvå(ac) => 2AlBr3(ac) + 3Ni (s) Återigen sker denna reaktion eftersom aluminium ligger över nickel i serien av kemiska aktiviteter. Sn (s) + HtvåSW4(ac) => SnSO4(ac) + Htvå(g) Här förskjuter tenn väte, även om det är mycket nära det i serien. 2K (s) + 2HtvåO (l) => 2KOH (aq) + Htvå(g) Slutligen är de metaller som finns i den högsta delen av serien så reaktiva att de även förskjuter väte i vattenmolekylerna och genererar en mycket exoterm reaktion (och explosiv).. Zn (NO3)två(aq) + 2NaOH (aq) => Zn (OH)två(s) + 2NaNO3(ac) Även om basen inte neutraliserar några syror, är OH-jonerna- känner mer affinitet för Zntvå+ att joner INTE är3-; av denna anledning inträffar dubbel förskjutning. Stämpel3)två(ac) + NatvåS (ac) => CuS (s) + 2NaNO3(ac) Denna reaktion är mycket lik den föregående, med skillnaden att båda föreningarna är salter lösta i vatten..Dubbel
Syra-basneutraliseringsreaktion
Exempel
Enkel
Dubbel
Referenser



Ingen har kommenterat den här artikeln än.