
Rhenium upptäckt, egenskaper, struktur, användningsområden
De renium Det är ett metalliskt grundämne vars kemiska symbol är Re, och det ligger i grupp 7 i det periodiska systemet, två platser under mangan. Det delar med detta och teknetium egenskapen att uppvisa flera nummer eller oxidationstillstånd, från +1 till +7. Det bildar också en anjon som kallas perrhenat, ReO4-, analogt med permanganat, MnO4-.
Denna metall är en av de sällsynta och knappa i naturen, så priset är högt. Det extraheras som en biprodukt av molybden och kopparbrytning. En av de mest relevanta egenskaperna hos renium är dess höga smältpunkt, knappt överträffad av kol och volfram, och dess höga densitet, som är dubbelt så hög som bly..

Hans upptäckt har kontroversiella och olyckliga övertoner. Namnet "rhenium" kommer från det latinska ordet "rhenus", vilket betyder Rhen, den berömda tyska floden nära platsen där de tyska kemisterna som isolerade och identifierade detta nya element fungerade..
Rhenium har många användningsområden, bland annat förfining av oktantalet bensin sticker ut, liksom vid tillverkning av eldfasta superlegeringar, avsedda för montering av turbiner och motorer för rymdskepp..
Artikelindex
- 1 Upptäckt
- 2 Egenskaper hos renium
- 2.1 Fysiskt utseende
- 2.2 Molmassa
- 2.3 Atomnummer
- 2.4 Smältpunkt
- 2.5 Kokpunkt
- 2.6 Densitet
- 2.7 Elektronegativitet
- 2.8 Joniseringsenergier
- 2.9 Molär värmekapacitet
- 2.10 Värmeledningsförmåga
- 2.11 Elektrisk resistivitet
- 2.12 Mohs hårdhet
- 2.13 Isotoper
- 2.14 Reaktivitet
- 3 Struktur och elektronisk konfiguration
- 3.1 oxidationstal
- 4 användningsområden
- 4.1 Bensin
- 4.2 Eldfasta superlegeringar
- 4.3 Volframfilament
- 5 Referenser
Upptäckt
Förekomsten av två tunga grundämnen med kemiska egenskaper som liknar mangan hade redan förutspåtts sedan åren 1869 genom den ryska kemisten Dmitri Mendeleevs periodiska system. Det var dock inte känt då vad deras atomnummer borde vara; och det var här 1913 som den engelska fysikern Henry Moseleys förutsägelse introducerades.
Enligt Moseley måste dessa två element som tillhör mangangruppen ha atomnummer 43 och 75.
Ett par år tidigare hade emellertid den japanska kemisten Masataka Ogawa upptäckt det förmodade elementet 43 i ett prov av mineralet torianit. Efter att ha meddelat sina resultat 1908 ville han döpa detta element med namnet 'Niponio'. Tyvärr visade kemister vid den tiden att Ogawa inte hade upptäckt element 43..
Och så gick andra år när tre tyska kemister 1925, Walter Noddack, Ida Noddack och Otto Berg, hittade element 75 i mineralprover av columbite, gadolinite och molybdenite. Dessa gav honom namnet renium, för att hedra floden Rhen i Tyskland ("Rhenus", på latin).
Masataka Ogawas misstag var att ha gjort fel identifiering av grundämnet: han hade upptäckt rhenium, inte element 43, kallat idag technetium..
Egenskaper hos renium
Fysiskt utseende
Rhenium marknadsförs vanligtvis som ett gråaktigt pulver. Dess metalliska bitar, i allmänhet sfäriska droppar, är silvergrå, som också är mycket glänsande..
Molmassa
186,207 g / mol
Atomnummer
75
Smältpunkt
3186 ºC
Kokpunkt
5630 ºC
Densitet
-Vid rumstemperatur: 21,02 g / cm3
-Rätt vid smältpunkt: 18,9 g / cm3
Rhenium är en metall som är nästan dubbelt så tät som bly i sig. Således kan en sfär av renium som väger 1 gram likställas med en robust blykristall med samma massa.
Elektronnegativitet
1.9 på Pauling-skalan
Joniseringsenergier
Först: 760 kJ / mol
Andra: 1260 kJ / mol
Tredje: 2510 kJ / mol
Molär värmekapacitet
25,48 J / (mol K)
Värmeledningsförmåga
48,0 W / (mK)
Elektrisk resistans
193 nΩ m
Mohs hårdhet
7
Isotoper
Rheniumatomer förekommer i naturen som två isotoper: 185Re, med ett överflöd på 37,4%; Y 187Re, med ett överflöd på 62,6%. Rhenium är ett av de grundämnen vars isotop är mest radioaktiv; dock halveringstiden för 187Re är mycket stor (4.121010 år), så det anses praktiskt taget stabilt.
Reaktivitet
Rheniummetall är ett rostbeständigt material. När det gör det, är det rost, RetvåELLER7, den flyktar vid höga temperaturer och brinner med en gulgrön flamma. Rhenium-bitar motstår HNO-attack3 koncentrerad; men när det är varmt löser det sig för att generera rensyra och kvävedioxid, vilket gör lösningen brun:
Re + 7HNO3 → HReO4 + 7 NEJtvå + 3HtvåELLER
Reniumets kemi är stor, eftersom den kan bilda föreningar med ett brett spektrum av oxidationsantal, liksom etablera en kvadrupolbindning mellan två reniumatomer (fyra Re-Re kovalenta bindningar)..
Struktur och elektronisk konfiguration
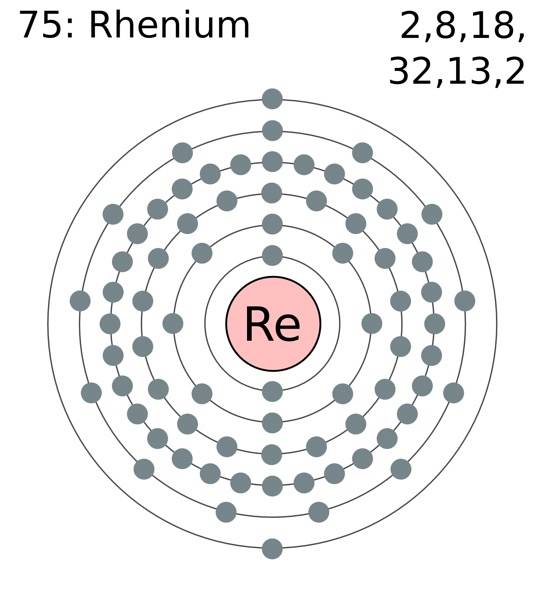
Reniumatomerna grupperas i sina kristaller för att bilda en kompakt sexkantig struktur, hcp, som kännetecknas av att den är mycket tät. Detta överensstämmer med det faktum att det är en metall med hög densitet. Metallbindningen, produkten av överlappningen av deras yttre orbitaler, håller Re-atomerna starkt sammanhängande.
I denna metallbindning, Re-Re, deltar valenselektronerna, som är i enlighet med den elektroniska konfigurationen:
[Xe] 4f14 5 d5 6stvå
I princip är det orbitalerna 5d och 6s som överlappar varandra för att komprimera Re-atomerna i hcp-strukturen. Observera att dess elektroner summerar sig till totalt 7, vilket motsvarar antalet i gruppen i det periodiska systemet..
Oxidationsnummer
Den elektroniska konfigurationen av rhenium tillåter oss att genast se att dess atom kan förlora upp till 7 elektroner, för att bli den hypotetiska katjonen Re7+. När Re existens antas7+ i vilken reniumförening som helst, exempelvis i RetvåELLER7 (Retvå7+ELLER7två-), sägs ha ett oxidationsnummer på +7, Re (VII).
Andra positiva oxidationsnummer för rhenium är: +1 (Re+), +2 (Retvå+), +3 (Re3+) och så vidare upp till +7. Renium kan också få elektroner genom att bli en anjon. I dessa fall sägs det ha ett negativt oxidationsnummer: -3 (Re3-), -2 (Retvå-) och -1 (Re-).
Applikationer
Bensin
Rhenium, tillsammans med platina, används för att skapa katalysatorer som ökar oktanklassificeringen för bensin, samtidigt som blyinnehållet sänks. Å andra sidan används rheniumkatalysatorer för flera hydreringsreaktioner, detta på grund av deras motståndskraft mot förgiftning av kväve, fosfor och svavel..
Eldfasta superlegeringar
Rhenium är en eldfast metall på grund av dess höga smältpunkt. Det är därför det tillsätts nickellegeringar för att göra dem eldfasta och beständiga mot höga tryck och temperaturer. Dessa superlegeringar används mest för design av turbiner och motorer för flygfartyg..
Volframfilament
Rhenium kan också bilda legeringar med volfram, vilket förbättrar dess duktilitet och därför underlättar tillverkningen av filamenten. Dessa renium-volframfilament används som röntgenkällor och för design av termoelement som kan mäta temperaturer upp till 2200 ºC..
På samma sätt användes dessa reniumfilament en gång för blixtar av arkaiska kameror, och nu för lampor av sofistikerad utrustning; såsom masspektrofotometer.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Sarah Pierce. (2020). Rhenium: Användningar, historia, fakta och isotoper. Studie. Återställd från: study.com
- Nationellt centrum för bioteknikinformation. (2020). Renium. PubChem-databas., CID = 23947. Återställd från: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2020). Renium. Återställd från: en.wikipedia.org
- Dr. Doug Stewart. (2020). Rhenium Element Fakta. Återställd från: chemicool.com
- Eric Scerri. (18 november 2008). Renium. Kemi i dess element. Återställd från: chemistryworld.com


Ingen har kommenterat den här artikeln än.