
Rubidium historia, egenskaper, struktur, erhållande, användningsområden
De rubidium Det är ett metallelement som tillhör grupp 1 i det periodiska systemet: alkalimetallernas, som representeras av den kemiska symbolen Rb. Namnet låter som rubin, och det beror på att när det upptäcktes visade dess utsläppsspektrum karaktäristiska linjer med djupröd färg..
Det är en av de mest reaktiva metaller som finns. Det är den första av alkalimetallerna som, trots att den inte är mycket tät, sjunker i vatten. Det reagerar också med det mer explosivt jämfört med litium, natrium och kalium. Det har gjorts experiment där blåsor spricker där det lagras (bottenbild) för att falla och explodera i badkar.

Rubidium kännetecknas av att det är en dyrare metall än guldet i sig; inte så mycket på grund av dess brist, men på grund av dess breda mineralogiska fördelning i jordskorpan och svårigheterna som uppstår när den isoleras från kalium- och cesiumföreningar..
Det visar en tydlig tendens att associera med kalium i dess mineraler, eftersom de finns som föroreningar. Inte bara i geokemiska frågor bildar det en duo med kalium utan också inom biokemi.
Organismen "förvirrar" K-jonerna+ av de av Rb+; emellertid är rubidium inte ett väsentligt element hittills, eftersom dess roll i ämnesomsättningen är okänd. Ändå har rubidiumtillskott använts för att lindra vissa medicinska tillstånd som depression och epilepsi. Å andra sidan avger båda jonerna en violett låga till tändarens värme.
På grund av dess höga kostnad baseras dess tillämpningar inte för mycket på syntesen av katalysatorer eller material, utan som en komponent för olika enheter med teoretiska fysiska baser. En av dem är atomuret, solceller och magnetometrar. Det är därför rubidium ibland betraktas som en undervärderad eller understuderad metall..
Artikelindex
- 1 Historia
- 2 Fysikaliska och kemiska egenskaper
- 2.1 Utseende
- 2.2 Atomnummer (Z)
- 2.3 Molmassa
- 2.4 Smältpunkt
- 2.5 Kokpunkt
- 2.6 Densitet
- 2.7 Fusionsvärme
- 2.8 Förångningsvärme
- 2.9 Elektronegativitet
- 2.10 Elektronisk affinitet
- 2.11 Joniseringsenergier
- 2.12 Atomradie
- 2.13 Värmeledningsförmåga
- 2.14 Elektrisk resistivitet
- 2.15 Mohs hårdhet
- 2.16 Reaktivitet
- 3 Struktur och elektronisk konfiguration
- 3.1 oxidationstal
- 3.2 Kluster
- 4 Var att hitta och få
- 4.1 Jordskorpa
- 4.2 Geokemisk förening
- 4.3 Fraktionerad kristallisation
- 4.4 Elektrolys eller reduktion
- 5 isotoper
- 6 risker
- 6.1 Metall
- 6,2 joner
- 7 användningsområden
- 7.1 Gassamlare
- 7.2 Pyroteknik
- 7.3 Tillägg
- 7.4 Bose-Einstein-kondensat
- 7.5 Diagnos av tumörer
- 7.6 Komponent
- 7.7 Atomklockor
- 8 Referenser
Berättelse
Rubidium upptäcktes 1861 av tyska kemister Robert Bunsen och Gustav Kirchhoff med spektroskopi. För att göra detta använde de Bunsenbrännaren och spektroskopet, som uppfanns två år tidigare, samt analytiska utfällningstekniker. Hans studieobjekt var mineralet lepidolit, vars prov samlades från Sachsen, Tyskland.
De startade från 150 kg lepidolitmineral, som de behandlade med kloroplatinsyra, HtvåPtCl6, för att fälla ut kaliumhexakloroplatinat, KtvåPtCl6. Men när de studerade dess spektrum genom att bränna det i Bunsen-brännaren insåg de att det uppvisade utsläppslinjer som inte sammanföll vid den tiden med något annat element..
Utsläppsspektrumet för detta nya element kännetecknas av att ha två väldefinierade linjer i den röda regionen. Det är därför de döpte det med namnet 'rubidus' som betyder 'mörkrött'. Senare lyckades Bunsen och Kirchhoff separera RbtvåPtCl6 från KtvåPtCl6 genom fraktionerad kristallisation; för att äntligen reducera det till sitt kloridsalt med hjälp av väte.
De tyska kemisterna identifierade och isolerade ett salt av det nya grundämnet rubidium, bara för att reducera det till dess metalliska tillstånd. För att uppnå detta försökte de på två sätt: applicera elektrolys på rubidiumklorid eller värma upp ett salt som är lättare att minska, såsom dess tartrat. Det var alltså det metalliska rubidium föddes.
Fysiska och kemiska egenskaper
Utseende
Mjuk, silvergrå metall. Det är så smidigt att det ser ut som smör. Det är vanligtvis förpackat i glasampuller, inom vilka en inert atmosfär dominerar som skyddar den från att reagera med luft..
Atomnummer (Z)
37
Molmassa
85,4678 g / mol
Smältpunkt
39 ºC
Kokpunkt
688 ºC
Densitet
Vid rumstemperatur: 1,532 g / cm3
Vid smältpunkt: 1,46 g / cm3
Densiteten hos rubidium är högre än för vatten, så den kommer att sjunka medan den reagerar våldsamt med den.
Fusionsvärme
2,19 kJ / mol
Förångningsvärme
69 kJ / mol
Elektronnegativitet
0,82 på Pauling-skalan
Elektronisk samhörighet
46,9 kJ / mol
Joniseringsenergier
-Först: 403 kJ / mol (Rb+ gasformig)
-Andra: 2632,1 kJ / mol (Rbtvå+ gasformig)
-Tredje: 3859,4 kJ / mol (Rb3+ gasformig)
Atomradio
248 (empiriskt)
Värmeledningsförmåga
58,2 W / (mK)
Elektrisk resistans
128 nΩm vid 20 ° C
Mohs hårdhet
0,3. Därför är även talk hårdare än metallisk rubidium..
Reaktivitet

Rubidium är en av de mest reaktiva alkalimetallerna efter cesium och francium. Så snart den utsätts för luft börjar den brinna, och om den träffas skjuter den lätt gnistor. Vid uppvärmning avger den också en violett låga (toppbild), vilket är ett positivt test för Rb-joner.+.
Reagerar med syre för att bilda en blandning av peroxider (RbtvåELLERtvå) och superoxider (RbOtvå). Även om det inte reagerar med syror och baser, reagerar det våldsamt med vatten och genererar rubidiumhydroxid och vätgas:
Rb (s) + HtvåO (l) => RbOH (aq) + Htvå(g)
Reagerar med väte för att bilda dess motsvarande hydrid:
Rb (s) + Htvå(g) => 2RbH (s)
Och även med halogener och svavel explosivt:
2Rb (s) + Cltvå(g) => RbCl (s)
2Rb (s) + S (l) => RbtvåH.H)
Även om rubidium inte anses vara ett giftigt element, är det potentiellt farligt och medför brandrisk när det kommer i kontakt med vatten och syre..
Struktur och elektronisk konfiguration
Rubidiumatomerna är ordnade på ett sådant sätt att de skapar en kristall med en kroppscentrerad kubisk struktur (bcc, för dess akronym på engelska body centered cubic). Denna struktur är karakteristisk för alkalimetaller, som är lätta och tenderar att flyta på vatten; utom från rubidium ner (cesium och francium).
I rubidium-bcc-kristaller interagerar deras Rb-atomer med varandra tack vare metallbindningen. Detta styrs av ett "hav av elektroner" från dess valensskal, från 5s-omloppet enligt dess elektroniska konfiguration:
[Kr] 5s1
Alla 5s orbitaler med sin enda elektron överlappar varandra i alla dimensioner av metalliska rubidiumkristaller. Dessa interaktioner är emellertid svaga, för när man faller ner genom alkalimetallgruppen blir orbitalerna mer diffusa och därför försvagas metallbindningen..
Därför är rubidiums smältpunkt 39 ° C. På samma sätt förklarar dess svaga metallbindning mjukheten hos dess fasta substans; så mjukt att det ser ut som silversmör.
Det finns inte tillräckligt med bibliografisk information om dess kristallers beteende under högt tryck; om det finns tätare faser med unika egenskaper som natrium.
Oxidationsnummer
Dess elektroniska konfiguration indikerar omedelbart att rubidium tenderar starkt att förlora sin enda elektron för att bli isoelektronisk mot ädelgas-krypton. När den gör det bildas den monovalenta katjonen Rb+. Det sägs sedan att det i dess föreningar har oxidationsnummer +1 när förekomsten av denna katjon antas.
På grund av tendensen hos rubidium att oxideras, antas antagandet att Rb-joner existerar+ i dess föreningar är korrekt, vilket i sin tur indikerar dessa karaktärers joniska karaktär.
I nästan alla rubidiumföreningar uppvisar det ett oxidationsnummer på +1. Exempel på dem är följande:
-Rubidiumklorid, RbCl (Rb+Cl-)
-Rubidiumhydroxid, RbOH (Rb+ Åh-)
-Rubidiumkarbonat, RbtvåCO3 (Rbtvå+CO3två-)
-Rubidiummonoxid, RbtvåO (Rbtvå+ELLERtvå-)
-Rubidium superoxid, RbOtvå (Rb+ELLERtvå-)
Även om det är mycket sällsynt kan rubidium också ha ett negativt oxidationsnummer: -1 (Rb-). I det här fallet skulle vi tala om en "rubidid" om den bildade en förening med ett element som är mindre elektronegativt än det, eller om det utsattes för under speciella och stränga förhållanden.
Kluster
Det finns föreningar där varje Rb-atom individuellt presenterar oxidationsnummer med bråkvärden. Till exempel i Rb6O (Rb6två+ELLERtvå-) och Rb9ELLERtvå (Rb94+ELLERtvåtvå-) den positiva laddningen fördelas mellan en uppsättning Rb-atomer (kluster). Således i Rb6Eller så skulle oxidationsnumret i teorin vara +1/3; medan i Rb9ELLERtvå, + 0,444 (4/9).
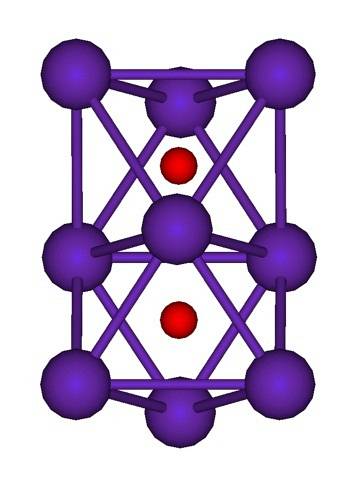
Klusterstrukturen för Rb visas ovan.9ELLERtvå representerad av en modell av sfärer och stänger. Observera hur de nio Rb-atomerna "omsluter" O-anjonerna.två-.
Som en klargöring är det som om en del av de ursprungliga metalliska rubidiumkristallerna förblev oförändrade medan de separerades från moderkristallen. De förlorar elektroner i processen; de som är nödvändiga för att locka Otvå-, och den resulterande positiva laddningen fördelas mellan alla atomer i nämnda kluster (uppsättning eller aggregat av Rb-atomer).
I dessa rubidiumkluster kan således inte Rb formellt antas.+. Rb6O och Rb9ELLERtvå De klassificeras som rubidiumsuboxider, i vilka denna uppenbara anomali att ha ett överskott av metallatomer i förhållande till oxidanjonerna uppfylls.
Var att hitta och få
jordskorpa

Rubidium är det 23: e mest förekommande elementet i jordskorpan, med ett överflöd som kan jämföras med metallerna zink, bly, cesium och koppar. Detaljen är att dess joner är mycket diffusa, så det dominerar inte i något mineral som det viktigaste metallelementet, och dess malm är också knappa..
Det är av den anledningen att rubidium är en mycket dyr metall, till och med mer än guld i sig, eftersom dess process att erhålla från malmen är komplex på grund av svårigheten att utnyttja den..
I naturen, med tanke på dess reaktivitet, finns inte rubidium i sitt ursprungliga tillstånd utan som en oxid (RbtvåO), klorid (RbCl) eller åtföljs av andra anjoner. Dess "fria" joner Rb+ finns i haven med en koncentration på 125 µg / L, liksom i varma källor och floder.
Bland de mineraler i jordskorpan som innehåller den i en koncentration på mindre än 1% har vi:
-Leucite, K [AlSitvåELLER6]
-Polucita, Cs (SitvåHej6NHtvåELLER
-Carnalite, KMgCl36HtvåELLER
-Zinnwaldite, KLiFeAl (AlSi3)ELLER10(OH, F)två
-Amazonit, Pb, KAlSi3ELLER8
-Petalite, LiAlSi4ELLER10
-Biotit, K (Mg, Fe)3AlSi3ELLER10(OH, F)två
-Rubicline, (Rb, K) AlSi3ELLER8
-Lepidolit, K (Li, Al)3(Ja, Al)4ELLER10(F, OH)två
Geokemisk förening
Alla dessa mineraler delar en eller två saker gemensamt: de är kalium-, cesium- eller litiumsilikater, eller de är mineralsalter av dessa metaller..
Detta innebär att rubidium har en stark tendens att associera med kalium och cesium; Det kan till och med ersätta kalium under kristalliseringen av mineraler eller stenar, som händer i avlagringar av pegmatiter när magma kristalliserar. Således är rubidium en biprodukt från exploatering och raffinering av dessa bergarter och deras mineraler..
Rubidium kan också hittas i vanliga bergarter som granit, leror och basalt och till och med i kolhaltiga avlagringar. Av alla naturliga källor representerar lepidolit dess huvudsakliga malm och från vilken den utnyttjas kommersiellt..
I karnalit kan å andra sidan rubidium hittas som RbCl-föroreningar med ett innehåll av 0,035%. Och i en högre koncentration finns avlagringar av polucit och rubiklin, som kan ha upp till 17% rubidium..
Dess geokemiska förening med kalium beror på likheten mellan deras joniska radier; Rb+ är större än K+, men storleksskillnaden är inte ett hinder för den första att kunna ersätta den andra i sina mineralkristaller.
Fraktionerad kristallisation
Oavsett om det börjar med lepidolit eller polucit eller med något av de mineraler som nämns ovan, förblir utmaningen densamma i större eller mindre grad: separera rubidium från kalium och cesium; det vill säga applicera blandningsseparationstekniker som gör det möjligt att ha rubidiumföreningar eller salter å ena sidan och de av kalium och cesium å andra sidan..
Detta är svårt eftersom dessa joner (K+, Rb+ och Cs+) har en stor kemisk likhet; De reagerar på samma sätt för att bilda samma salter, som knappast skiljer sig från varandra tack vare deras densiteter och lösligheter. Det är därför fraktionerad kristallisering används så att de kan kristallisera långsamt och på ett kontrollerat sätt..
Till exempel används denna teknik för att separera en blandning av karbonater och alun från dessa metaller. Omkristallisationsprocesserna måste upprepas flera gånger för att garantera kristaller med större renhet och fria från samutfällda joner; ett rubidiumsalt som kristalliserar med K-joner+ eller Cs+ på dess yta eller insida.
Mer moderna tekniker, såsom användning av ett jonbytesharts, eller kronetrar som komplexbildande medel, möjliggör också isolering av Rb-joner.+.
Elektrolys eller reduktion
När rubidiumsaltet har separerats och renats är nästa och sista steg att minska Rb-katjonerna+ till solid metall. För att göra detta smälts saltet och utsätts för elektrolys så att rubidium fälls ut på katoden; eller ett starkt reducerande medel används, såsom kalcium och natrium, med förmåga att snabbt förlora elektroner och därmed reducera rubidium.
Isotoper
Rubidium finns på jorden som två naturliga isotoper: 85Rb och 87Rb. Den första har ett överflöd på 72,17%, medan den andra har 27,83%.
De 87Rb är ansvarig för att denna metall är radioaktiv; dess strålning är dock ofarlig och till och med fördelaktig för dateringsanalys. Dess halveringstid (t1/2) är 4,91010 år, vars tidsperiod överstiger universums ålder. När den förfaller blir den den stabila isotopen 87herr.
Tack vare detta har denna isotop använts för att datera jordens mineraler och bergarter från jordens början..
Förutom isotoper 85Rb och 87Rb, det finns andra syntetiska och radioaktiva med varierande och mycket kortare livstid; Till exempel honom 82Rb (t1/2= 76 sekunder), 83Rb (t1/2= 86,2 dagar), 84Rb (t1/2= 32,9 dagar) och 86Rb (t1/2= 18,7 dagar). Av dem alla har 82Rb är den mest använda i medicinska studier.
Risker
Metall
Rubidium är en sådan reaktiv metall att den måste förvaras i glasampuller under en inert atmosfär så att den inte reagerar med syre i luften. Om blåsan går sönder kan metallen placeras i fotogen eller mineralolja för att skydda den. emellertid kommer det att sluta oxideras av syret som är upplöst i dem, vilket ger upphov till rubidiumperoxider.
Om det tvärtom beslutas att placera det på exempelvis trä, kommer det att sluta brinna med en violett låga. Om det finns mycket luftfuktighet kommer det att brinna bara genom att utsättas för luften. När en stor bit rubidium kastas i en vattenvolym exploderar den kraftigt och antänds till och med den vätgas som produceras.
Därför är rubidium en metall som inte alla ska hantera, eftersom praktiskt taget alla dess reaktioner är explosiva..
Jon
Till skillnad från metallisk rubidium, dess Rb-joner+ de utgör ingen uppenbar risk för levande varelser. Dessa upplösta i vatten interagerar med celler på samma sätt som K-joner gör.+.
Därför har rubidium och kalium liknande biokemiska beteenden; emellertid är rubidium inte ett väsentligt element, medan kalium är. På detta sätt märkbara mängder Rb+ kan ackumuleras inuti celler, röda blodkroppar och inälvor utan att negativt påverka kroppen hos något djur.
I själva verket har man uppskattat att en vuxen man med en massa av 80 kg innehåller cirka 37 mg rubidium; och att dessutom en ökning av denna koncentration i storleksordningen 50 till 100 gånger inte leder till oönskade symtom.
Emellertid ett överskott av Rb-joner+ kan sluta förskjuta K-jonerna+; och följaktligen kommer individen att drabbas av mycket starka muskelspasmer fram till döden.
Uppenbarligen kan lösliga rubidiumsalter eller föreningar utlösa detta omedelbart, så ingen av dem ska intas. Dessutom kan det orsaka brännskador genom enkel kontakt, och bland de mest giftiga kan vi nämna fluorid (RbF), hydroxid (RbOH) och cyanid (RbCN) av rubidium.
Applikationer
Gassamlare
Rubidium har använts för att fånga upp eller ta bort spår av gaser som kan finnas i vakuumförslutna rör. Just på grund av deras höga tendens att fånga syre och fukt i dem eliminerar de dem på deras yta som peroxider.
Pyroteknik
När rubidiumsalter brinner avger de en karakteristisk rödviolett låga. Vissa fyrverkerier har dessa salter i sin sammansättning så att de exploderar med dessa färger.
Tillägg
Rubidiumklorid har ordinerats för att bekämpa depression, eftersom studier bestämde en brist på detta element hos individer som lider av detta medicinska tillstånd. Det har också använts som ett lugnande medel och för att behandla epilepsi.
Bose-Einstein kondensat
Isotopatomer 87Rb användes för att skapa det första Bose-Einstein-kondensatet. Detta tillstånd av materia består i att atomerna vid en temperatur som är ganska nära absolut noll (0 K), är grupperade eller "kondenserade" och beter sig som om de vore en..
Således var rubidium huvudpersonen i denna triumf inom fysikområdet, och det var Eric Cornell, Carl Wieman och Wolfgang Ketterle som fick Nobelpriset 2001 tack vare detta arbete..
Tumördiagnos
Den syntetiska radioisotopen 82Rb sönderfaller genom att avge positroner, som används för att ackumuleras i kaliumrika vävnader; som de som finns i hjärnan eller hjärtat. Det används således för att analysera hjärtets funktionalitet och närvaron av möjliga tumörer i hjärnan med hjälp av en positronemissionstomografi..
Komponent
Rubidiumjoner har hittat en plats i olika typer av material eller blandningar. Till exempel har hans legeringar gjorts med guld, cesium, kvicksilver, natrium och kalium. Det har tillsatts glas och keramik förmodligen för att öka deras smältpunkt.
I solceller har perovskiter lagts till som en viktig komponent. På samma sätt har dess möjliga användning som en termoelektrisk generator, värmeöverföringsmaterial i rymden, bränsle i jonen framdrivningsmotorer, elektrolytiskt medium för alkaliska batterier och i atommagnetometrar också studerats..
Atomklockor
Med rubidium och cesium har de berömda mycket exakta atomuren tillverkats, som till exempel används i GPS-satelliter som ägarna till deras smartphones kan känna till var de befinner sig på väg.
Referenser
- Bond Tom. (29 oktober 2008). Rubidium. Återställd från: chemistryworld.com
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Wikipedia. (2019). Rubidium. Återställd från: en.wikipedia.org
- Nationellt centrum för bioteknikinformation. (2019). Rubidium. PubChem-databas. CID = 5357696. Återställd från: pubchem.ncbi.nlm.nih.gov
- Chellan, P., & Sadler, P. J. (2015). Elementen i livet och läkemedel. Filosofiska transaktioner. Serie A, matematik, fysik och teknikvetenskap, 373 (2037), 20140182. doi: 10.1098 / rsta.2014.0182
- Mayo Foundation för medicinsk utbildning och forskning. (2019). Rubidium Rb 82 (intravenös väg). Återställd från: mayoclinic.org
- Marques Miguel. (s.f.). Rubidium. Återställd från: nautilus.fis.uc.pt
- James L. Dye. (12 april 2019). Rubidium. Encyclopædia Britannica. Återställd från: britannica.com
- Dr. Doug Stewart. (2019). Fakta om Rubidium Element. Chemicool. Återställd från: chemicool.com
- Michael Pilgaard. (10 maj 2017). Rubidium kemiska reaktioner. Återställd från: pilgaardelements.com



Ingen har kommenterat den här artikeln än.