
Koncentrerade lösningsfunktioner och exempel

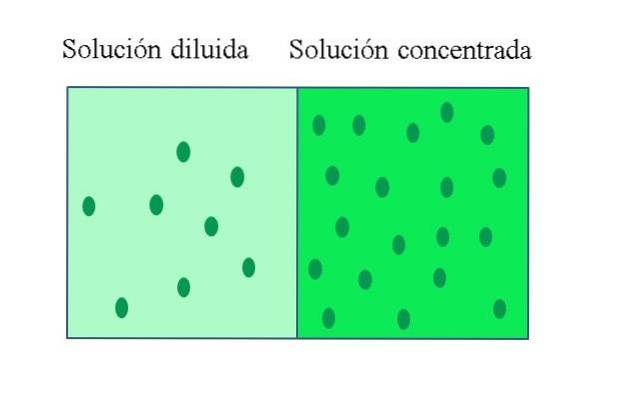
A koncentrerad lösning Det är en som innehåller en stor mängd löst i förhållande till den mängd den kan lösa upp; medan en utspädd lösning har en låg koncentration av löst ämne. En utspädd lösning kan framställas från en koncentrerad lösning genom att tillsätta lösningsmedel till den, eller om möjligt extrahera löst ämne från den..
Konceptet kan vara relativt, eftersom det som definierar en koncentrerad lösning är höga värden i vissa av dess egenskaper; till exempel har en glassmaräng hög koncentration av socker, vilket bevisas av dess söta smak.
Den koncentrerade lösningsmedlets koncentration är nära eller lika med en mättad lösning. Huvudegenskaperna hos en mättad lösning är att den inte kan lösa ytterligare en mängd löst ämne vid en viss temperatur. Därför förblir koncentrationen av löst ämne i dess mättade lösningar konstant..
Lösligheten för de flesta lösta ämnen ökar med ökande temperatur. På detta sätt kan en ytterligare mängd löst solubiliseras i en mättad lösning..
Sedan temperaturen sjunker ökas den lösta koncentrationen av den mättade lösningen. I det här fallet talar vi om en övermättad lösning.
Artikelindex
- 1 Kännetecknande för en koncentrerad lösning
- 2 Kolligativa egenskaper hos lösningar
- 2.1 Osmolaritet och osmolalitet
- 2.2 Ångtrycksreduktion
- 2.3 Nedstigning av den kryoskopiska punkten
- 2.4 Kokpunktens höjd
- 2.5 Osmotiskt tryck
- 3 Skillnader med utspädd lösning
- 4 Exempel på lösningar
- 4.1 Koncentrerad
- 4.2 Utspädd
- 5 Referenser
Karakteristisk för en koncentrerad lösning
Koncentrationen av en lösning, det vill säga förhållandet mellan mängden av ett löst ämne och mängden av en lösning eller lösningsmedel, kan uttryckas som en procentandel av löst ämne i lösningen (P / V eller P / P).
Det kan också uttryckas i mol löst material per liter lösning (molaritet) och lösta ekvivalenter per liter lösning (normalitet).
På samma sätt är det vanligt att uttrycka koncentrationen av en lösning i mol löst ämne per kg lösningsmedel (molalitet) eller att uttrycka den i mol löst i förhållande till den totala molen av lösningen (molär fraktion). I utspädda lösningar är det vanligt att hitta koncentrationen av en lösning i p.p.m. (delar per miljon).
Oavsett uttrycksformen för koncentrationen av en lösning, har en koncentrerad lösning en hög andel av det lösta ämnet, i detta fall uttryckt som massa, i förhållande till massan eller volymen av lösningen eller lösningsmedlet. Denna koncentration är lika med lösligheten av lösningsmedlet i lösningsmedlet eller mycket nära dess värde..
Kolligativa egenskaper hos lösningar
De är en uppsättning egenskaper hos lösningar som beror på antalet partiklar i lösningen oavsett typ.
De kolligativa egenskaperna diskriminerar inte partiklarnas egenskaper, vare sig de är atomer av natrium, klor, glukos etc. Det viktiga är ditt nummer.
På grund av detta faktum blev det nödvändigt att skapa ett annat sätt att uttrycka koncentrationen av en lösning som är relaterad till de så kallade kolligativa egenskaperna. Som svar på detta skapades uttrycken osmolaritet och osmolalitet.
Osmolaritet och osmolalitet
Osmolaritet är relaterad till lösningens molaritet och osmolalitet till dess molalitet..
Enheterna för osmolaritet är osm / L lösning eller mosm / L lösning. Medan enheterna av osmolalitet är osm / kg vatten eller mosm / kg vatten.
Osmolaritet = mvg
m = lösningens molaritet.
v = antal partiklar i vilka en förening dissocieras i vattenlösning. Till exempel: för NaCl har v ett värde på 2; för CaCltvå, v har ett värde av 3 och för glukos, en elektrolytisk förening som inte dissocierar, har v ett värde av 1.
g = osmotisk koefficient, korrigeringsfaktor för växelverkan mellan elektriskt laddade partiklar i lösning. Denna korrektionsfaktor har ett värde nära 1 för utspädda lösningar och tenderar att vara noll när molariteten hos elektrolytföreningen ökar..
De kolligativa egenskaperna nämns nedan, som gör det möjligt att bestämma hur mycket en lösning är koncentrerad.
Ångtrycksreduktion
När vattnet värms upp förångas det och den ånga som bildas utövar ett tryck. När tillsatt löst ämne minskar ångtrycket.
Därför har koncentrerade lösningar ett lågt ångtryck. Förklaringen är att lösta molekyler förskjuter vattenmolekyler vid gränsytan mellan vatten och luft..
Kryoskopisk nedstigning
När en lösnings osmolaritet ökar, minskar temperaturen vid vilken den vattenhaltiga lösningen fryser. Om frystemperaturen för rent vatten är 0 ° C blir frysningstemperaturen för en koncentrerad vattenlösning lägre än det värdet..
Kokpunktens höjd
Enligt Raoults lag är höjningen av kokpunkten för det rena lösningsmedlet direkt proportionell mot molariteten hos lösningen som härrör från tillsatsen av löst ämne. Därför har koncentrerade lösningar en högre kokpunkt än vatten..
Osmotiskt tryck
Det finns två fack med olika koncentrationer, åtskilda av ett membran som låter vatten passera genom, men begränsar passage av lösta partiklar..
Vattnet kommer att strömma från lösningen med den lägsta koncentrationen av löst ämne till lösningen med den högsta koncentrationen av löst ämne.
Detta nettoflöde av vatten kommer gradvis att försvinna när det ackumulerade vattnet i facket med den högsta koncentrationen genererar ett hydrostatiskt tryck som motsätter flödet av vatten in i detta fack..
Flödet av vatten genom osmos sker vanligtvis mot koncentrerade lösningar.
Skillnader med utspädd lösning
-Koncentrerade lösningar har en hög andel löst i förhållande till volym eller massa av lösningen. Utspädda lösningar har en låg andel löst i förhållande till lösningens volym eller massa.
-De har högre molaritet, molalitet och normalitet än de för utspädda lösningar.
-Fryspunkten för koncentrerade lösningar är lägre än för utspädda lösningar; det vill säga de fryser vid kallare temperaturer.
-En koncentrerad lösning har lägre ångtryck än en utspädd lösning.
-Koncentrerade lösningar har en högre kokpunkt än utspädda lösningar.
-Sätt i kontakt genom ett halvgenomträngligt membran, vattnet kommer att strömma från de utspädda lösningarna till de koncentrerade lösningarna.
Exempel på lösningar
Koncentrerad
-Honung är en mättad lösning av socker. Det är vanligt att observera förekomsten av omkristallisation av socker, vilket framgår av locken på behållarna som innehåller honung.
-Havsvatten som har en hög koncentration av olika salter.
-Urin från personer med svår uttorkning.
-Kolsyrat vatten är en mättad lösning av koldioxid.
Utspädd
-Urin från en person med överdrivet vattenintag.
-Svett är vanligtvis låg osmolaritet.
-Många läkemedel som ges i lösningsform har låg koncentration.
Referenser
- Wikipedia. (2018). Koncentration. Återställd från: es.wikipedia.org
- Falst L. (2018). Koncentration av lösningar: Definition och nivåer. Studie. Återställd från: study.com
- The Chemistry Companion for Middle School Teachers- Exempel. (s.f.). Lösningar och koncentration. [PDF]. Återställd från: ice.chem.wisc.edu
- Vattenlösningar - molaritet. Återställd från: chem.ucla.edu
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.



Ingen har kommenterat den här artikeln än.