
Kalciumsulfat (CaSO4) Kemisk struktur, egenskaper, användningar

De kalciumsulfat Det är ett ternärt salt av kalcium, jordalkalimetall (Mr. Becambara), svavel och syre. Dess kemiska formel är CaSO4, vilket betyder att för varje katjon Catvå+ det finns en anjon så4två- interagerar med det. Det utgör en förening med stor fördelning i naturen.
Dess mest förekommande former är CaSO42HtvåO (gips) och den vattenfria formen CaSO4 (anhydriten). Det finns också en tredje form: gips av Paris, producerad genom att värma gipset (hemidrat, CaSO41 / 2HtvåELLER). En fast del av detta ternära salt visas i den nedre bilden med sitt vitaktiga utseende..

Artikelindex
- 1 Kemisk struktur
- 2 fastigheter
- 2.1 Molekylformel
- 2.2 Vattenfri molekylvikt
- 2.3 Lukt
- 2.4 Utseende
- 2.5 Densitet
- 2.6 Smältpunkt
- 2.7 Löslighet
- 2.8 Stabilitet
- 3 användningsområden
- 3.1 Inom konstruktion och konst
- 3.2 Terapeutiska medel
- 3.3 I livsmedelsbearbetning
- 3.4 Som gödningsmedel och balsam för grödor
- 3.5 Vid framställning av andra föreningar
- 4 Referenser
Kemisk struktur
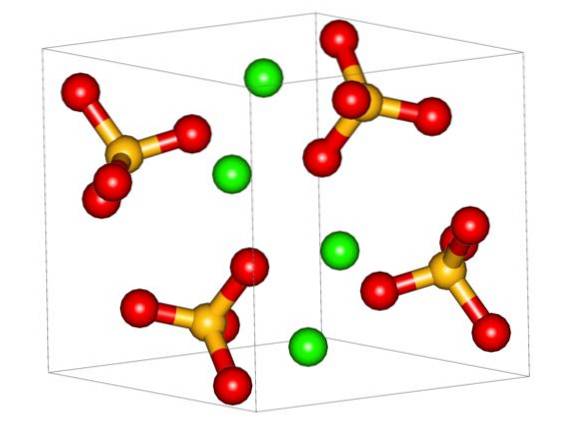
Den övre bilden visar den ortorombiska enhetscellen för CaSO4. Här antas att interaktionerna är rent elektrostatiska; det vill säga katjonerna Catvå+ locka tetraedriska anjoner SO4två-.
Emellertid Catvå+ det är mycket benäget att samordna och bildar polyhedrala strukturer runt det. För vad är det här? Till den elektroniska tillgängligheten av kalcium för att acceptera elektroner av basiska eller negativa arter (såsom O-atomerna i SO4två-).
Med tanke på den tidigare punkten, nu Ca-jonernatvå+ De accepterar dativlänkar (tillhandahållna av Os) och enhetscellen transformeras, vilket anges i bilden nedan:
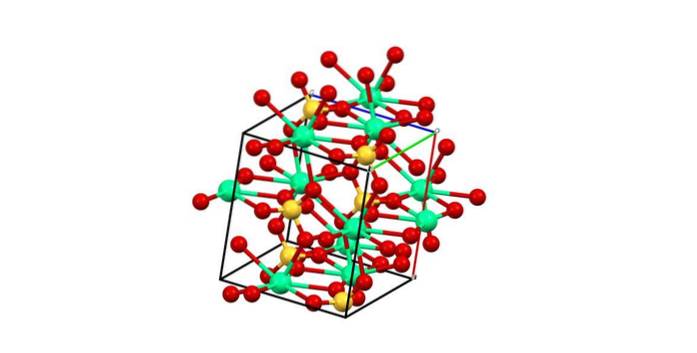
Följaktligen bildas polyeder CaO8 (den gröna sfären av Catvå+ omgiven av åtta röda sfärer av O från SO tetraedra4 närliggande). Kalciumpolyeder och sulfattetraeder; detta är den kristallina strukturen av CaSO4 vattenfri.
Dessutom, när kristallerna hydrerar - bildar det dihydrerade saltet eller hemidratet (CaSO41/2 HtvåO) - strukturen expanderar och innehåller vattenmolekyler.
Dessa molekyler kan interkalera och samordna med kalcium; det vill säga de ersätter en eller två sulfatgrupper.
Å andra sidan blir inte allt vatten en del av CaO-polyhedronen.8. Vissa bildar å andra sidan vätebindningar med sulfater. Dessa fungerar som en förening för två sicksackavsnitt, produkter av jonernas arrangemang i kristallen.
Egenskaper
Molekylär formel
CaSO4 nH20.
Vattenfri molekylvikt
136,134 g / mol.
Odör
Det är luktfritt.
Utseende
När det gäller anhydrit ser det ut som ett vitt pulver eller fasta ortorombiska eller monokliniska kristaller. Kristallerna har varierande färg: de kan vara vita eller med en blåaktig, gråaktig eller rödaktig nyans; kan också vara tegelrött.
Densitet
2,96 g / cm3 (vattenfri form). 2,32 gr / cm3 (dihydratform).
Smältpunkt
1450 ° C (2840 ° F). Karakteristisk för starka elektrostatiska interaktioner mellan tvåvärda Ca-jonertvå+ Och så4två-.
Löslighet
0,2-0,3% i vatten vid 25 ° C Det är dåligt lösligt i vatten och olösligt i etanol.
Stabilitet
Stabil vid rumstemperatur.
Applikationer

Inom konstruktion och konst
Den används vid utarbetandet av stuckatur för att frysa väggarna i hem och andra konstruktioner som bidrar till dess försköning. Dessutom görs avlastningar med hjälp av formar i tak och fönsterramar. Gipsen är också i taket.
Kalciumsulfat används för att hjälpa till att lösa problemet som uppstår vid hydrering av betong och därmed samarbeta i byggandet av vägar, vägar etc..
Med gips görs skulpturer, särskilt religiösa figurer, och på kyrkogårdar används de på gravstenar.
Terapeutik
veterinär
Experimentellt har inom veterinärmedicin sterila bitar av kalciumsulfat använts för att reparera benfel eller håligheter, såsom de som lämnas av sår eller tumörer..
Plaster of Paris kan användas för att reparera benfel på grund av dess unika förmåga att stimulera osteogenes. Röntgenstudier och technetium (Tc99m) medronat stöder användningen av gips i Paris som en alloplast och dess osteogena förmåga när den implanteras i den främre bihålan.
Benregenerering har demonstrerats hos sex hundar under en period av 4 till 6 månader. Kalciumsulfat började användas på detta område 1957, i form av gips av Paris-tabletter, som kunde fylla defekter i hundens ben..
Bensubstitutionen av kalciumsulfat är jämförbar med den som observerats i autogent ben.
Ruhaimi (2001) applicerade kalciumsulfat på ett nyligen förstört kaninkäftben och observerade en ökning av osteogenes och benförkalkning..
Medicin
Kalciumsulfat används i medicinen för att immobilisera förskjutna leder och brutna ben, såväl som att det används som hjälpämne vid tillverkning av tabletter..
odontologi
I tandvården används det som grund för tillverkning av tandproteser, vid restaureringar och avtryck av tänderna..
I livsmedelsbearbetning
Det används som ett koaguleringsmedel vid produktionen av tofu, en mat som tillverkas med soja och som konsumeras i östra länder som en ersättning för kött. Dessutom har den använts som en uppstramning av mat och vid behandling av mjöl.
Som gödningsmedel och balsam för grödor
Gips (CaSO42HtvåO) användes som gödningsmedel i Europa sedan artonhundratalet, med fördelen över användningen av kalk som en källkälla för större rörlighet.
Kalcium måste finnas tillgängligt för växternas rötter för att det ska vara tillräckligt bra. Så tillsatsen av kalcium förbättrar grödor för jordbruk och jordnötter (jordnötter)..
Jordnötsrotröta orsakad av biologiska patogener, liksom vattenmelon och tomatblossrutt, kontrolleras delvis med jordbruksgipsapplikationer..
Gips hjälper till att minska spridningen av lera, vilket orsakar bildning av skorpor på marken. Genom att minska skorporna som bildas på marken underlättar gipset plantornas utgång. Det ökar också inträde av luft och vatten till marken.
Gips hjälper till att förbättra jorden genom att mildra aluminiumens surhet och toxicitet och därigenom anpassa grödan till natriumjord..
Vid framställning av andra föreningar
Kalciumsulfat reagerar med ammoniumbikarbonat för att bilda ammoniumsulfat. Det har också använts i produktionsprocessen för svavelsyra.
Vattenfritt kalciumsulfat blandas med skiffer eller magert och när blandningen upphettas frigörs svaveltioxid i gasform. Svaveloxid är en föregångare till svavelsyra.
Referenser
- Rökfot. (26 december 2015). Struktur av CaSO4. [Figur]. Hämtad den 6 maj 2018 från: commons.wikimedia.org
- Takanori Fukami et al. (2015). Syntes, kristallstruktur och termiska egenskaper hos CaSO42HtvåEller enkla kristaller. International Journal of Chemistry; Vol. 7, nr 2; ISSN 1916-9698 E-ISSN 1916-9701 Publicerat av Canadian Center of Science and Education.
- PubChem. (2018). Kalciumsulfat. Hämtad den 6 maj 2018 från: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Kalciumsulfat. Hämtad den 6 maj 2018 från: en.wikipedia.org
- Elsevier. (2018). kalciumsulfat. Hämtad den 6 maj 2018 från: sciencedirect.com
- Kimberlitesoftwares. (2018). Kalciumsulfat. Hämtad den 6 maj 2018 från: worldofchemicals.com
- Intagri. (2017). Manual för användning av jordbruksgips som jordförbättrare. Hämtad den 6 maj 2018 från: intagri.com



Ingen har kommenterat den här artikeln än.