
Natriumnitrit (NaNO2) struktur, egenskaper, användningsområden, risker

De natriumnitrit är ett kristallint oorganiskt fast ämne bildat av en natriumjon Na+ och en nitritjon NOtvå-. Dess kemiska formel är NaNOtvå. Det är ett vitt kristallint fast ämne som tenderar att absorbera vatten från miljön, det vill säga det är hygroskopiskt.
I närvaro av luft oxiderar den långsamt till natriumnitrat NaNO3. Det har oxiderande egenskaper (det oxiderar andra föreningar) och reducerar också egenskaper (det oxideras av andra föreningar).

Det finns naturligt i människokroppen och används som konserveringsmedel för härdat kött och rökt fisk eftersom det förhindrar tillväxt av skadliga mikroorganismer..
Det har en viktig användning vid akutbehandling av cyanidförgiftning, eftersom det minskar den toxiska och dödliga effekten av denna förening. Det måste emellertid administreras med stor försiktighet och fungerar inte i alla fall.
Det har visat sig att det kan förhindra ögoninfektioner orsakade av kontaminering av kontaktlinser av mikroorganismer. Vissa studier tyder på att dess konsumtion med mat kan orsaka cancer, men det uppskattas att detta kan undvikas genom att inta C-vitamin med sådana livsmedel..
Artikelindex
- 1 Struktur
- 2 Nomenklatur
- 3 fastigheter
- 3.1 Fysiskt tillstånd
- 3.2 Molekylvikt
- 3.3 Smältpunkt
- 3.4 Kokpunkt
- 3.5 Densitet
- 3.6 Löslighet
- 3,7 pH
- 3.8 Övriga egenskaper
- 4 Skaffa
- 4.1 Närvaro i kroppen
- 5 användningsområden
- 5.1 I livsmedelsindustrin
- 5.2 Som akut behandling vid cyanidförgiftning
- 5.3 För utvidgning av blodkärl
- 5.4 Mot vissa parasiter
- 5.5 För att undvika organskador
- 5.6 För att undvika infektioner på grund av användning av kontaktlinser
- 5.7 I olika användningsområden
- 6 Risker eller olägenheter
- 7 Referenser
Strukturera
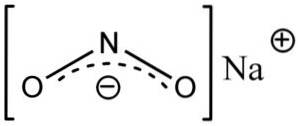
Natriumnitrit består av natriumkatjonen Na+ och nitritanjonen NOtvå-.
I nitritanjonen NOtvå- kväve har en valens av +3 och syre av -2, av denna anledning har anjonen en enda global negativ laddning.
Nitritanjon NOtvå- har en vinkelstruktur, det vill säga bindningarna av kväve (N) med syreatomer (O) bildar en vinkel.
Nomenklatur
- Natriumnitrit
- Natriumnitrit
- Salpetersyranatriumsalt.
Egenskaper
Fysiskt tillstånd
Gulvitt kristallint fast ämne. Ortorhombiska kristaller.
Molekylvikt
68,995 g / mol
Smältpunkt
271 ºC
Kokpunkt
Det kokar inte. Den sönderdelas över 320 ºC
Densitet
2,17 g / cm3 vid 20 ºC
Löslighet
Lösligt i vatten: 84,8 g / 100 g vatten vid 25 ºC. Något lösligt i etanol. Måttligt löslig i metanol. Sparsamt lösligt i dietyleter.
pH
Dess vattenhaltiga lösningar är alkaliska, med ett pH på cirka 9. Detta beror på att salpetersyra är en svag syra som tenderar att inte dissocieras, så NO-jonentvå- försök ta ett proton H+ vatten för att bilda HNOtvå, vilket leder till bildandet av OH-joner- som producerar alkalinitet.
INTEtvå- + HtvåO → HNOtvå + Åh-
Andra egenskaper
Natriumnitrit NaNOtvå i närvaro av luft oxideras långsamt till natriumnitrat NaNO3. Det är ett hygroskopiskt fast ämne, eftersom det absorberar vatten från miljön.
Det har oxiderande egenskaper (det kan oxidera andra föreningar) och även reducerande egenskaper (det kan oxideras av andra föreningar).
Om den kommer i kontakt med material som trä, papper eller textilier kan det få dem att antändas farligt..
Med syror sker dess sönderdelning och genererar en blandning av bruntoxiska gaser av kväveoxider (NOx).
Erhållande
Det kan erhållas genom upphettning av natriumnitrat NaNO3 med bly Pb:
Äldre bror3 + Pb → NaNOtvå + PbO
Närvaro i kroppen
Nitritanjon finns naturligt i blod och vävnader, eftersom den bildas som ett resultat av NO-oxidation..
Applikationer
I livsmedelsindustrin
Det används för att marinera kött eftersom det fungerar som ett färg- och smakretentionsmedel och som ett konserveringsmedel eftersom det kontrollerar tillväxten av mikroorganismer, vilket särskilt undviker utveckling av Clostridium botulinum orsakar botulism.
Natriumnitrit i kött reagerar med hemoglobin i röda blodkroppar eller röda blodkroppar i denna mat. Används även i härdad rökt fisk.

Som en akut behandling för cyanidförgiftning
Natriumnitrit används för att behandla akut cyanidförgiftning. Det är ett motgift mot detta allvarliga problem.
Dess verkan beror på det faktum att det gynnar bildandet av metemoglobin (en typ av hemoglobin) i blodet, som fångar cyanidjoner och inte frigör dem och därmed förhindrar dem från att släppas ut i celler, vilket gör dem mindre giftiga.
Vid cyanidförgiftning appliceras natriumnitrit intravenöst, vilket tar cirka 12 minuter att generera metemoglobin. Trots denna fördröjning erbjuder den också skydd på grund av dess vasodilaterande effekt..
För utvidgning av blodkärl
Det används för att behandla pulmonell arteriell hypertoni eftersom det fungerar genom att utvidga blodkärlen och därmed sänka blodtrycket. Det uppskattas att denna effekt beror på att den omvandlas till kväveoxid NO som verkar genom att slappna av de mjuka musklerna.
Orsakerna till dess effektivitet studeras dock fortfarande..
Mot vissa parasiter
Vissa forskare fann att natriumnitrit hämmar tillväxten och förökningen av tarmparasiten Blastocystis hominis även om det är resistent mot andra mediciner.
NaNO hittadestvå genererar död av denna parasit genom apoptos, vilket är ett slags självmord på parasitcellen. Natriumnitrit får tarmceller att producera NO, vilket verkar vara viktigt i denna process.
För att undvika organskador
Enligt vissa studier är nitrit en kraftfull hämmare av skador på hjärtat och levern i ischemiska processer (minskat blodflöde i en del av kroppen). Detta antas bero på det faktum att det är en biologisk reserv av NO.
Man drog slutsatsen att det kan användas för att förhindra organskador efter att ha återställt blodflödet som har avbrutits av hjärtinfarkt, högriskbukoperation eller organtransplantation..
För att undvika infektioner från att ha kontaktlinser
NaNO har hittatstvå förhindrar bildandet av filmer av patogena mikroorganismer Staphylococcus aureus Y Pseudomonas aeruginosa om kontaktlinser.

I olika användningsområden
Natriumnitrit används för att framställa färgämnen, läkemedel och olika organiska föreningar.
Fungerar också som en korrosionsinhibitor i universalfetter.
Risker eller olägenheter
Ett av problemen med att använda natriumnitrit för cyanidförgiftningar är att det orsakar allvarliga hjärt-kärlsjukdomar hos barn..
Rekommenderas inte för brandoffer där samtidig exponering för både cyanid och kolmonoxid (CO) förekommer. CO minskar blodets förmåga att transportera syre, så administrering av NaNOtvå skulle förvärra tillståndet med lågt syreinnehåll i patientens blod.
Inhalerad natriumnitrit är irriterande och giftigt, det kan skada hjärt-kärlsystemet och centrala nervsystemet. Dessutom är det skadligt för miljön.
Natriumnitrit som intas med mat kan vara skadligt. När nitrit når magen reagerar det med vissa föreningar som bildar nitrosaminer, vilket kan orsaka cancer.
Dessa reaktioner kan undvikas i närvaro av vitamin C.
Enligt vissa källor som konsulterats är risken för att konsumera nitrit med härdat kött eller fisk minimal eftersom nitrit är naturligt närvarande i saliv.
Källorna indikerar att denna risk också är minimal jämfört med de stora fördelarna med att konsumera mat utan skadliga mikroorganismer.
Referenser
- Bhattacharya, R. och Flora, S.J.S. (2015). Cyanidtoxicitet och dess behandling. I Handbook of Toxicology of Chemical Warfare Agents (andra upplagan). Återställd från sciencedirect.com.
- USA National Library of Medicine. (2019). Natriumnitrit. Återställd från: pubchem.ncbi.nlm.nih.gov.
- Kim, D.J. et al. (2017). Antibiofilms effektivitet av kväveoxid på mjuka kontaktlinser. BMC Ophthalmol 17, 206 (2017). Återställd från bmcophthalmol.biomedcentral.com.
- Ramis-Ramos, G. (2003). Antioxidanter. Syntetiska antioxidanter. I Encyclopedia of Food Sciences and Nutrition (andra upplagan). Återställd från sciencedirect.
- Barozzi Seabra, A. och Durán, N. (2017). Kväveoxiddonatorer för behandling av försummade sjukdomar. I kväveoxidgivare. Återställd från sciencedirect.com.
- Duranski, M.R. et al. (2005). Cytoprotektiva effekter av nitrit under in vivo ischemi-reperfusion av hjärtat och levern. J Clin Invest 2005; 115 (5): 1232-1240. Återställd från ncbi.nlm.nih.gov.
- Cotton, F. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.



Ingen har kommenterat den här artikeln än.