
Silversulfid (Ag2S) struktur, egenskaper och användningsområden
De silversulfid är en oorganisk förening vars kemiska formel är AgtvåS. Den består av ett gråsvart fast ämne bildat av katjoner Ag+ och S-anjonertvå- i förhållandet 2: 1. Stvå- är mycket besläktad med Ag+, eftersom båda är mjuka joner och lyckas stabilisera sig med varandra.
Silverprydnader tenderar att mörkna och förlorar sin karaktäristiska glans. Färgförändringen är inte en produkt av oxidationen av silver, utan av dess reaktion med vätesulfid närvarande i miljön vid låga koncentrationer; detta kan komma från ruttnande eller nedbrytning av växter, djur eller livsmedel rik på svavel.

HtvåS, vars molekyl bär en svavelatom, reagerar med silver enligt följande kemiska ekvation: 2Ag (s) + HtvåS (g) => AgtvåS (s) + Htvå(g)
Därför är AgtvåS är ansvarig för de svarta skikten som bildas på silver. Men i naturen finns denna sulfid också i mineralerna Acantite och Argentite. De två mineralerna skiljer sig från många andra genom sina blanka svarta kristaller, som den i det fasta i bilden ovan..
AGtvåS har polymorfa strukturer, attraktiva elektroniska och optoelektroniska egenskaper, är en halvledare och lovar att vara ett material för tillverkning av solcelleanordningar, såsom solceller..
Artikelindex
- 1 Struktur
- 2 fastigheter
- 2.1 Molekylvikt
- 2.2 Utseende
- 2.3 Lukt
- 2.4 Smältpunkt
- 2.5 Löslighet
- 2.6 Struktur
- 2.7 Brytningsindex
- 2.8 Dielektrisk konstant
- 2.9 Elektronik
- 2.10 Reduktionsreaktion
- 3 Nomenklatur
- 3.1 Systematik
- 3.2 Lager
- 3.3 Traditionell
- 4 användningsområden
- 5 Referenser
Strukturera
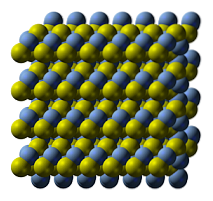
Den övre bilden illustrerar kristallstrukturen av silversulfid. De blå sfärerna motsvarar Ag-katjonerna+, medan de gula till S-anjonernatvå-. AGtvåS är polymorf, vilket innebär att den kan använda olika kristallsystem under vissa temperaturförhållanden..
Hur? Genom en fasövergång. Jonerna ordnas på ett sådant sätt att temperaturökningen och det fasta ämnets vibrationer inte stör den elektrostatiska dragningsbalansen. När detta händer sägs det att det sker en fasövergång, och det fasta ämnet uppvisar därför nya fysiska egenskaper (som glans och färg)..
AGtvåS vid normala temperaturer (under 179 ° C), har den en monoklinisk kristallstruktur (α- AgtvåS). Förutom denna fasta fas finns det två andra: bcc (kubik centrerad på kroppen) mellan 179 och 586 ° C, och fcc (kubik centrerad på ansikten) vid mycket höga temperaturer (δ- AgtvåS).
Mineralet argentit består av fcc-fasen, även känd som β-AgtvåS. När den väl har svalnat och omvandlats till akantit råder dess strukturella egenskaper kombinerat. Därför existerar båda kristallina strukturerna: monoklinik och bcc. Därför dyker svarta fasta ämnen med ljusa och intressanta övertoner upp..
Egenskaper
Molekylvikt
247,80 g / mol
Utseende
Gråsvarta kristaller
Odör
Toalett.
Smältpunkt
836 ° C Detta värde överensstämmer med det faktum att AgtvåS är en förening med liten jonisk karaktär och smälter därför vid temperaturer under 1000 ° C.
Löslighet
Endast i vatten 6.21 ∙ 10-femton g / L vid 25 ° C Det vill säga mängden av det svarta fasta ämnet som solubiliseras är försumbar. Detta beror återigen på Ag-S-bindningens låga polära karaktär, där det inte finns någon signifikant skillnad i elektronegativitet mellan de två atomerna..
Även AgtvåS är olösligt i alla lösningsmedel. Ingen molekyl kan effektivt separera sina kristallina skikt i Ag-joner+ och Stvå- solvatiserad.
Strukturera
I bilden av strukturen kan du också se fyra lager av S-Ag-S-bindningar, som rör sig över varandra när det fasta ämnet utsätts för kompression. Detta beteende innebär att det trots att det är en halvledare är duktilt som många metaller vid rumstemperatur..
S-Ag-S-lager passar ordentligt på grund av deras vinkelgeometrier som ses som en sicksack. Eftersom det finns en kompressionskraft rör sig de på en förskjutningsaxel, vilket orsakar nya icke-kovalenta interaktioner mellan silver- och svavelatomer..
Brytningsindex
2.2
Dielektrisk konstant
6
Elektronisk
AGtvåS är en amfoter halvledare, det vill säga den beter sig som om den var av typen n och av typen sid. Dessutom är det inte sprött, så det har studerats för dess tillämpning i elektroniska enheter..
Reduktionsreaktion
AGtvåS kan reduceras till metalliskt silver genom att bada de svarta bitarna med varmt vatten, NaOH, aluminium och salt. Följande reaktion äger rum:
3AgtvåS (s) + 2Al (s) + 3HtvåO (l) => 6Ag (s) + 3HtvåS (ac) + AltvåELLER3(s)
Nomenklatur
Silver vars elektronkonfiguration är [Kr] 4d105s1, det kan bara förlora en elektron: dess yttersta 5-banor. Således kan katjonen Ag+ sitter kvar med en elektronkonfiguration [Kr] 4d10. Därför har den en unik valens på +1, som avgör vad dess föreningar ska kallas..
Svavel har å andra sidan elektronisk konfiguration [Ne] 3stvå3p4, och det krävs två elektroner för att slutföra valensoktet. När den får dessa två elektroner (från silver) förvandlas den till sulfidanjonen, Stvå-, med [Ar] -inställning. Det vill säga det är isoelektroniskt mot ädelgasargonet.
Så AgtvåS måste anropas enligt följande nomenklaturer:
Systematisk
Apasulfid av gavsilver. Här beaktas antalet atomer för varje element och de är markerade med prefixen för grekiska täljare.
Stock
Silversulfid. Eftersom den har en unik valens på +1, specificeras den inte med romerska siffror inom parentes: silver (I) sulfid; vilket är fel.
Traditionell
Silversulfidico. Eftersom silver "fungerar" med en valens på +1 läggs suffixet -ico till sitt namn. argentum På latin.
Applikationer
Några av de nya användningsområdena för AgtvåS är som följer:
-De kolloidala lösningarna av dess nanopartiklar (med olika storlekar) har antibakteriell aktivitet, är inte giftiga och kan därför användas inom medicin och biologi..
-Dess nanopartiklar kan bilda så kallade kvantprickar. De absorberar och avger strålning med större intensitet än många fluorescerande organiska molekyler, så att de kan ersätta de senare som biologiska markörer.
-Strukturerna för α-AgtvåS gör att den uppvisar slående elektroniska egenskaper som ska användas som solceller. På samma sätt representerar den en utgångspunkt för syntesen av nya termoelektriska material och sensorer..
Referenser
- Mark Peplow. (17 april 2018). Halvledarsilversulfid sträcker sig som metall. Hämtad från: cen.acs.org
- Samarbete: Författare och redaktörer av volymerna III / 17E-17F-41C () Silversulfid (Ag2S) kristallstruktur. I: Madelung O., Rössler U., Schulz M. (red.) Icke-tetrahedriskt bundna element och binära föreningar I. Landolt-Börnstein - Grupp III kondenserat material (numeriska data och funktionella förhållanden inom vetenskap och teknik), vol 41C. Springer, Berlin, Heidelberg.
- Wikipedia. (2018). Silversulfid. Hämtad från: en.wikipedia.org
- Stanislav I. Sadovnikov & kol. (Juli 2016). AgtvåS silversulfid nanopartiklar och kolloidala lösningar: Syntes och egenskaper. Hämtad från: sciencedirect.com
- Azo Material. (2018). Silversulfid (AgtvåS) Halvledare. Hämtad från: azom.com
- A. Nwofe. (2015). Utsikter och utmaningar med silversulfid tunna filmer: En recension. Avdelningen för materialvetenskap och förnybar energi, Institutionen för industriell fysik, Ebonyi State University, Abakaliki, Nigeria.
- UMassAmherst. (2011). Föreläsningsdemonstrationer: rengöring av lackerat silver. Hämtad från: lecturedemos.chem.umass.edu
- Studie. (2018). Vad är silversulfid? - Kemisk formel och användning. Hämtad från: study.com

Ingen har kommenterat den här artikeln än.