
Natriumsulfidformler, användningar, risker
De natriumsulfid (Na2S) är en gul till tegelröd kristallin fast substans. I naturen finns den i olika hydratiseringsgrader, den vanligaste är natriumsulfid nonahydrat (Na2S 9H2O).
De är vattenlösliga salter som ger starkt alkaliska lösningar. När de utsätts för fuktig luft absorberar de fukt från luften och kan värmas upp spontant och orsaka antändning av närliggande brännbara material. På samma sätt, i kontakt med fuktig luft, avger de vätesulfid, som luktar som ruttna ägg..

De är starka reduktionsmedel. Dessa ämnen kan vara farliga för miljön, särskilt för vattenlevande organismer.
Natriummonosulfid levereras kommersiellt i flingform innehållande 60-62% NatvåS ...
- Formler

- CAS: 1313-82-2 Natriumsulfid (vattenfri)
- CAS: 1313-84-4 Natriumsulfid (nonahydrat)
2D-struktur
3D-struktur

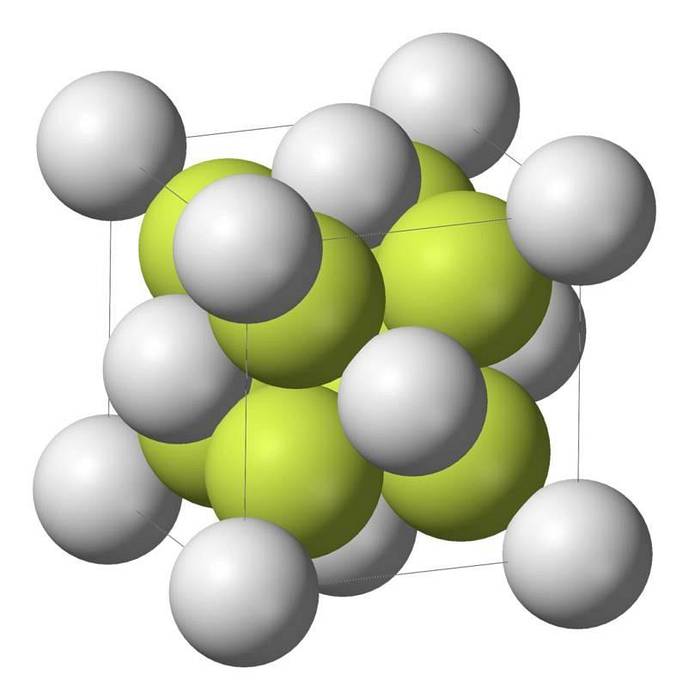
Kännetecken för natriumsulfid
Fysiska och kemiska egenskaper

Natriummonosulfid (Na2S) kristalliserar med antifluoritstrukturen, i vilken varje S-atom är omgiven av en kub med 8 Na-atomer och varje Na-atom av en tetraeder med 4 S-atomer..
Eldfarlighet
Den enda mycket brandfarliga medlemmen i den oorganiska sulfidgruppen är vätesulfid. Vissa andra oorganiska sulfider, såsom natriumsulfid, kan emellertid spontant värmas upp och till och med antändas om de utsätts för fukt..
Vid exponering för eld släpper natriumsulfid ut svaveldioxidgaser eller ångor som är irriterande eller giftiga.
Reaktivitet
- Oorganiska sulfider är i allmänhet basiska (vissa är starkt basiska och därför oförenliga med syror).
- Många av dessa föreningar är reduktionsmedel (de reagerar kraftigt med oxidationsmedel).
- Enkla sulfidsalter (såsom natrium, kalium och ammoniumsulfid) reagerar kraftigt med syror för att frigöra mycket giftig och brandfarlig vätesulfidgas..
- Natriumsulfid är brandfarligt. Kan explodera vid uppvärmning snabbt eller träffa.
- Vid uppvärmning till nedbrytning avger den giftiga ångor av natriumoxid och svaveloxider.
- Reagerar våldsamt med kol, kol, diazoniumsalter, N, N-diklormetylamin, starka oxidationsmedel och vatten.
Giftighet
Många av medlemmarna i den oorganiska sulfidgruppen beter sig som starka baser och kan orsaka svåra brännskador vid hudkontakt..
Denna egenskap beror på dess löslighet. De mer olösliga oorganiska sulfiderna (t.ex. kvicksilver (II) sulfid och kadmiumsulfid) är inte frätande.
Natriumsulfid har en medeloktanol / vatten-fördelningskoefficient (Pow) (-3,5). Detta värde används som ett mått på ett ämnes löslighet (och biokoncentration) i animaliska fettvävnader (särskilt vattenlevande djur)..
Natriumsulfid anses vara farligt för miljön, särskilt för vattenlevande organismer.
Applikationer
I hemmet används natriumsulfid i avloppsrengöringsmedel, hushållsrengöringsmedel (för ugn, badrum), plattång, diskmaskintvål och bilkrockkuddar..
Inom industrin används det i rengöringsmedel, i cement och som föregångare vid produktion av andra kemikalier.
Kliniska effekter
Exponering för natriumsulfid är vanligt i utvecklade och underutvecklade länder, både inom industrin och hemma. Dessa frätande ämnen finns i olika hushållsprodukter i låga koncentrationer..
I utvecklade länder är allvarliga effekter sällsynta. Dessa inträffar främst från avsiktligt intag av kemikalien hos vuxna. Men i utvecklingsländer är allvarliga effekter vanligare.
Alkaliska frätande ämnen orsakar flytande nekros. De förtvålar fetterna i cellmembranet, förstör cellen och möjliggör djup penetration i slemhinnevävnaden.
Oral exponering
Initial inflammation uppträder i mag-tarmvävnad, följt av vävnadsnekros (med möjlig perforering), sedan granulering och slutligen bildning av strängning.
Patienter med milt intag utvecklar irritation av grad I eller brännskador (ytlig hyperemi och ödem) i orofarynx, matstrupe eller mage..
Patienter med måttlig berusning kan utveckla grad II-brännskador (ytliga blåsor, erosioner och sårbildning) med möjlig efterföljande strängbildning (särskilt matstrupen)..
Vissa patienter (särskilt små barn) kan utveckla övre luftvägsödem.
Patienter med allvarlig berusning vid intag kan utveckla djupa brännskador och nekros i mag-tarmslemhinnan med komplikationer såsom: perforering (matstrupe, gastrisk, sällan duodenal), fistelbildning (trakeesofageal, aortosofageal) och gastrointestinal blödning..
Kan utvecklas: hypotoni, takykardi, takypné, striktbildning (huvudsakligen esofagus), matstrupencancer och övre luftvägsödem (vilket är vanligt och ofta livshotande).
Allvarlig berusning är vanligtvis begränsad till avsiktligt intag hos vuxna.
Exponering vid inandning
Mild exponering kan orsaka hosta och bronkospasm.
Allvarlig inandning kan orsaka övre luftvägsödem, brännskador, stridor och sällan akut lungskada..
Okulär exponering
Det kan orsaka allvarlig konjunktivalirritation och kemos, epitelfel i hornhinnan, limbisk ischemi, permanent synförlust och i svåra fall av perforering.
Dermal exponering
Mild exponering orsakar irritation och delvis brännskador på tjockleken. Metabolisk acidos kan utvecklas hos patienter med svåra brännskador eller chock..
Långvarig exponering eller högkoncentrationsprodukter kan orsaka brännskador i full tjocklek.
Säkerhet och risker
Faroangivelser från det globalt harmoniserade systemet för klassificering och märkning av kemikalier (GHS)
Det globalt harmoniserade systemet för klassificering och märkning av kemikalier (GHS) är ett internationellt överenskommet system, skapat av FN och utformat för att ersätta de olika klassificerings- och märkningsstandarder som används i olika länder genom att använda enhetliga kriterier globalt..
Faroklasserna (och motsvarande GHS-kapitel), klassificerings- och märkningsstandarder och rekommendationer för natriumsulfid är följande (European Chemicals Agency, 2017; FN, 2015; PubChem, 2017):







Referenser
- Benjah-bmm27, (2006). Fluoritenhet-cell-3D-jonisk [bild] Återställd från: wikipedia.org.
- ChemIDplus, (2017). 1313-82-2 [bild] Återställd från: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D-struktur av 1313-82-2 - Natriumsulfid [bild] Återställd från: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D-struktur av 1313-84-4 - Natriumsulfid [bild] Återställd från: chem.nlm.nih.gov.
- Europeiska kemikaliemyndigheten (ECHA). (2017). Sammanfattning av klassificering och märkning.
- Harmoniserad klassificering - Bilaga VI till förordning (EG) nr 1272/2008 (CLP-förordningen). Natriumsulfid. Hämtad den 16 januari 2017 från: echa.europa.eu.
- Europeiska kemikaliemyndigheten (ECHA). (2017). Sammanfattning av klassificering och märkning.
- Anmälad klassificering och märkning. Natriumsulfid, hydratiserad. Hämtad den 16 januari 2017 från: echa.europa.eu.
- Databank för farliga ämnen (HSDB). TOXNET. (2017). Natriumsulfid. Bethesda, MD, EU: National Library of Medicine. Återställd från: toxnet.nlm.nih.gov.
- Lange, L., & Triebel, W. (2000). Sulfider, polysulfider och sulfaner. I Ullmanns Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH & Co. KGaA. Återställd från dx.doi.org.
- FN (2015). Globalt harmoniserat system för klassificering och märkning av kemikalier (GHS) Sjätte reviderade utgåvan. New York, EU: FN: s publikation. Återställd från: unece.org.
- Nationellt centrum för bioteknikinformation. PubChem Compound Database. (2016). Sodium Sulfide enneahydrate - PubChem Structure [image] Hämtad från: pubchem.ncbi.nlm.nih.gov.
- Nationellt centrum för bioteknikinformation. PubChem Compound Database. (2017). Natriummonosulfid. Bethesda, MD, EU: National Library of Medicine. Återställd från: pubchem.ncbi.nlm.nih.gov.
- Nationellt centrum för bioteknikinformation. PubChem Compound Database. (2017). Natriumsulfid ennhydrat. Bethesda, MD, EU: National Library of Medicine. Återställd från: pubchem.ncbi.nlm.nih.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Kemiskt datablad. Vattenfri natriumsulfid. Silver Spring, MD. EU; Återställd från: cameochemicals.noaa.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Datablad för reaktiv grupp. Sulfider, oorganiska. Silver Spring, MD. EU; Återställd från: cameochemicals.noaa.gov.
- Ondřej Mangl, (2007). Sulfid sodný - Na2S [bild] Återställd från: wikipedia.org.
- PubChem, (2016). Natriummonosulfid [bild] Återställd från: puchem.nlm.nih.gov.
- PubChem, (2016). Natriumsulfid ennhydrat [bild] Återställd från: puchem.nlm.nih.gov.
- Wikipedia. (2017). Fördelningskoefficient oktanol-vatten. Hämtad 17 januari 2017 från: wikipedia.org.
- .



Ingen har kommenterat den här artikeln än.