
Bromhistoria, struktur, elektronkonfiguration, egenskaper, användningsområden
De brom Det är ett icke-metalliskt element som tillhör gruppen halogener, grupp 17 (VIIA) i det periodiska systemet. Dess kemiska symbol är Br.Den verkar som en diatomisk molekyl, vars atomer är kopplade till en kovalent bindning, för vilken den tilldelas molekylformeln Brtvå.
Till skillnad från fluor och klor är brom under markförhållanden inte en gas utan en rödbrun vätska (bilden nedan). Det är fumling, och det är tillsammans med kvicksilver, de enda flytande elementen. Under det kan jod, även om det intensifierar sin färg och blir lila, kristallisera till ett flyktigt fast ämne.

Brom upptäcktes självständigt 1825 av Carl Löwig, som studerade under ledning av den tyska kemisten Leopold Gmelin; och 1826 av den franska kemisten Antoine-Jérome Balard. Men publiceringen av Balards experimentella resultat föregick Löwigs..
Brom är det 62: a vanligaste elementet på jorden och distribueras i låga koncentrationer genom jordskorpan. I havet är den genomsnittliga koncentrationen 65 ppm. Människokroppen innehåller 0,0004% brom, och dess funktion är inte definitivt känd..
Detta element utnyttjas kommersiellt i saltlake eller platser som på grund av speciella förhållanden är platser med hög koncentration av salter; till exempel Döda havet, till vilket vattnet i de angränsande områdena konvergerar, mättat med salter.
Det är ett frätande element som kan angripa metaller, såsom platina och palladium. Löst i vatten, kan brom också utöva sin frätande verkan på mänskliga vävnader, vilket förvärrar situationen eftersom bromvätesyra kan genereras. När det gäller dess toxicitet kan det orsaka betydande skador på organ, såsom lever, njurar, lungor och mage.
Brom är mycket skadligt i atmosfären och är 40-100 gånger mer destruktivt för ozonskiktet än klor. Halva förlusten av ozonskiktet i Antarktis produceras av reaktioner relaterade till brometyl, en förening som används som rökmedel.
Den har många användningsområden, såsom: brandskyddsmedel, blekmedel, ytdesinfektionsmedel, bränsletillsatsmedel, mellanprodukt vid tillverkning av lugnande medel, vid tillverkning av organiska kemikalier etc..
Artikelindex
- 1 Historia
- 1.1 Carl Löwigs arbete
- 1.2 Antoine Balards arbete
- 2 Struktur och elektronkonfiguration av brom
- 2.1 Molekyl
- 2.2 Kristaller
- 2.3 Valensskikt och oxidationstillstånd
- 3 fastigheter
- 3.1 Fysiskt utseende
- 3.2 Atomvikt
- 3,3 atomnummer
- 3.4 Lukt
- 3.5 Smältpunkt
- 3.6 Kokpunkt
- 3.7 Densitet (Br2) vätska
- 3.8 Löslighet i vatten
- 3.9 Lösligheter
- 3.10 Trippelpunkt
- 3.11 Kritisk punkt
- 3.12 Fusionsvärme (Br2)
- 3.13 Förångningsvärme (Br2)
- 3.14 Molär värmekapacitet (Br2)
- 3.15 Ångtryck
- 3.16 Självantändningstemperatur
- 3.17 Flampunkt
- 3.18 Lagringstemperatur
- 3.19 Ytspänning
- 3.20 Lukttröskel
- 3.21 Brytningsindex (ηD)
- 3.22 Elektronegativitet
- 3.23 Joniseringsenergi
- 3.24 Atomradie
- 3.25 Kovalent radie
- 3.26 Van der Waals radie
- 3.27 Reaktivitet
- 4 användningsområden
- 4.1 Bensintillsats
- 4.2 Bekämpningsmedel
- 4.3 Kontroll av kvicksilverutsläpp
- 4.4 Fotografering
- 4.5 Terapeutiska åtgärder
- 4.6 Brandskyddsmedel
- 4.7 Livsmedelstillsats
- 4.8 Reagenser och kemisk mellanprodukt
- 4.9 Biologiska åtgärder
- 5 Var du hittar
- 6 risker
- 7 Referenser
Berättelse
Carl Löwigs arbete
Brom upptäcktes oberoende och nästan samtidigt av Carl Jacob Löwig, en tysk kemist 1825, och av Antoine Balard, en fransk kemist 1826..
Carl Löwig, en lärjunge av den tyska kemisten Leopold Gmelin, samlade vatten från en källa i Bad Kreuznach och tillsatte klor till den; efter tillsatsen av etern omrördes den flytande blandningen.
Därefter avdestillerades etern och koncentrerades genom indunstning. Som ett resultat erhöll han en rödbrun substans, som var brom.
Antoine Balards arbete
Balard använde för sin del aska från en brunalger som kallades fucus och blandade dem med saltlösning, extraherat från saltlägenheterna i Montpellier. Således släppte han brom och fick klor att passera genom det vattenhaltiga materialet som utsattes för extraktion, i vilket magnesiumbromiden, MgBr, var närvarande.två.
Därefter destillerades materialet i närvaro av mangandioxid och svavelsyra, vilket gav röda ångor som kondenserades till en mörk vätska. Balard trodde att det var ett nytt element och kallade det muride, härledt från det latinska ordet muria, med vilket saltlake betecknades.
Det har noterats att Balard bytte namn från muride till brôme på förslag från Anglada eller Gay-Lussac, baserat på det faktum att brôme betyder foul, vilket definierar lukten av det upptäckta elementet..
Resultaten publicerades av Belard i Annales of Chemie and Physique innan Löwig publicerade hans.
Först från 1858 var det möjligt att producera brom i betydande mängder; år upptäcktes och utnyttjades Stassfurt saltavlagringar, vilket gav brom som en biprodukt av kaliumchlorid.
Struktur och elektronkonfiguration av brom
Molekyl

Den övre bilden visar brommolekylen, Brtvå, med en kompakt fyllningsmodell. Egentligen finns det en enkel kovalent bindning mellan de två bromatomerna, Br-Br.
Eftersom den är en homogen och diatomisk molekyl saknar den ett permanent dipolmoment och kan bara interagera med andra av samma typ med hjälp av Londons dispersionskrafter..
Detta är anledningen till att dess rödaktiga vätska röker; i Br-molekylertvå, även om de är relativt tunga håller deras intermolekylära krafter dem löst ihop.
Brom är mindre elektronegativ än klor och har därför en mindre attraktiv effekt på elektronerna i valenskal. Som ett resultat kräver det mindre energi för att resa högre energinivåer, absorbera gröna fotoner och reflektera en rödaktig färg..
Kristaller
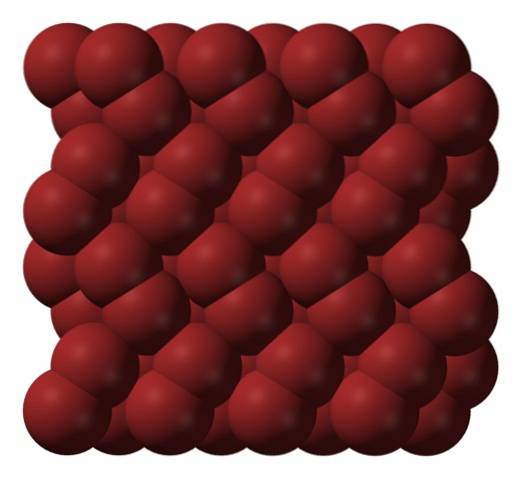
I gasfasen, Br-molekylernatvå de skiljer sig avsevärt tills det inte finns några effektiva interaktioner mellan dem. Men under dess smältpunkt kan brom frysa i rödaktiga ortorombiska kristaller (toppbild).
Observera hur Br-molekylernatvå de är ordnade snyggt på ett sådant sätt att de ser ut som "brommaskar". Här och vid dessa temperaturer (T < -7,2°C), las fuerzas de dispersión son suficientes para que las vibraciones de las moléculas no desmoronen el cristal en el acto; pero aún así, varias de ellas sublimarán constantemente.
Valensskikt och oxidationstillstånd
Elektronkonfigurationen för brom är:
[Ar] 3d104stvå 4p5
Att vara 3d104stvå 4p5 dess valensskal (även om 3d-banan10 spelar inte en ledande roll i deras kemiska reaktioner). Elektronerna i 4- och 4p-orbitalerna är de yttersta och sammanlagt sju, bara en elektron från fullbordandet av valensoktet.
Från denna konfiguration kan de möjliga oxidationstillstånden för brom härledas: -1, om den får en elektron att vara isoelektronisk mot krypton; +1, kvar som 3d104stvå 4p4; +3, +4 och +5, förlorar alla elektroner från 4p-banan ([Ar] 3d104stvå4p0); och +7, och lämnar inga elektroner i 4s-banan ([Ar] 3d104s04p0).
Egenskaper
Fysiskt utseende
Mörk rödbrun rökande vätska. Det finns i naturen som en diatomisk molekyl, med atomerna kopplade till en kovalent bindning. Brom är en flytande tätare än vatten och sjunker i den.
Atomvikt
79,904 g / mol.
Atomnummer
35.
Odör
En skarp, kvävande och irriterande rök.
Smältpunkt
-7,2 ºC.
Kokpunkt
58,8 ºC.
Densitet (Brtvå) flytande
3,1028 g / cm3
Vattenlöslighet
33,6 g / L vid 25 ° C Lösligheten av brom i vatten är låg och tenderar att öka med sjunkande temperatur; beteenden som liknar andra gaser.
Lösligheter
Fritt löslig i alkohol, eter, kloroform, koltetraklorid, koldisulfid och koncentrerad saltsyra. Lösligt i icke-polära och vissa polära lösningsmedel såsom alkohol, svavelsyra och många halogenerade lösningsmedel.
Trippel punkt
265,9 K till 5,8 kPa.
Kritisk punkt
588 K vid 10,34 MPa.
Fusionsvärme (Brtvå)
10,571 kJ / mol.
Förångningsvärme (Brtvå)
29,96 kJ / mol.
Molär värmekapacitet (Brtvå)
75,69 kJ / mol.
Ångtryck
Vid en temperatur av 270 K, 10 kPa.
Självantändningstemperatur
Ej brandfarligt.
antändningspunkt
113 ºC.
Förvaringstemperatur
2 till 8 ºC.
Ytspänning
40,9 mN / m vid 25 ºC.
Lukttröskel
0,05-3,5 ppm. 0,39 mg / m3
Brytningsindex (ηD)
1,6083 vid 20 ° C och 1,6478 vid 25 ° C.
Elektronnegativitet
2,96 på Pauling-skalan.
Joniseringsenergi
- Första nivå: 1 139,9 kJ / mol.
- Andra nivån: 2 103 kJ / mol.
- Tredje nivån: 3.470 kJ / mol.
Atomradio
120.00.
Kovalent radie
120.3.
Van der Waals radio
Kl. 185.
Reaktivitet
Det är mindre reaktivt än klor, men mer reaktivt än jod. Det är en oxidant som är mindre stark än klor och starkare än jod. Det är också ett svagare reduktionsmedel än jod, men starkare än klor..
Klorånga är mycket frätande för många material och mänskliga vävnader. Angriper många metallelement, inklusive platina och palladium; men det attackerar inte bly, nickel, magnesium, järn, zink och under 300 ºC varken natrium.
Brom i vatten genomgår en förändring och förvandlas till bromid. Det kan också finnas som bromat (BrO3-beroende på vätskans pH.
På grund av dess oxiderande verkan kan brom inducera frisättning av syrefria radikaler. Dessa är starka oxidationsmedel och kan orsaka vävnadsskador. Brom kan också spontant antändas i kombination med kalium, fosfor eller tenn..
Applikationer
Bensintillsats
Etylendibromid användes för att avlägsna potentiella blyavlagringar från bilmotorer. Efter förbränningen av bensin, som använde bly som tillsats, kombinerades brom med bly för att bilda blybromid, en flyktig gas som drevs ut genom avgasröret..
Även om brom avlägsnade bly från bensin var dess destruktiva verkan på ozonskiktet mycket kraftfull, varför det kastades för denna applikation.
Bekämpningsmedel
Metylen eller brometylbromid användes som bekämpningsmedel för att rena jord, speciellt för att eliminera parasitiska nematoder, såsom krokmask..
Emellertid har användningen av de flesta av de brominnehållande föreningarna kasserats på grund av deras destruktiva verkan på ozonskiktet..
Kvicksilverutsläppskontroll
Brom används i vissa anläggningar för att minska utsläppet av kvicksilver, en mycket giftig metall..
Fotografi
Silverbromid används, förutom silverjodid och silverklorid, som en ljuskänslig förening i fotografiska emulsioner.
Terapeutiska åtgärder
Kaliumbromid, liksom litiumbromid, användes som allmänna lugnande medel under 1800- och början av 1900-talet. Bromider i form av enkla salter används fortfarande i vissa länder som antikonvulsiva medel.
Det amerikanska FDA godkänner dock inte användningen av brom för behandling av någon sjukdom idag..
Brandskyddsmedel
Brom omvandlas av lågor till bromvätesyra, som stör oxidationsreaktionen som uppstår under brand och orsakar dess utrotning. Brominnehållande polymerer används för att framställa brandhämmande hartser.
Livsmedelstillsats
Spår av kaliumbromat har tillsatts mjöl för att förbättra matlagningen.
Reagenser och kemiska mellanprodukter
Vätebromid används som reduktionsmedel och katalysator för organiska reaktioner. Brom används som en kemisk mellanprodukt vid tillverkning av läkemedel, hydraulvätskor, kylmedel, avfuktare och i hårkrullningspreparat.
Det finner också användning vid produktion av brunnborrvätskor, produkter för desinfektion av vatten, blekmedel, desinfektionsmedel för ytan, färgämnen, bränsletillsatser etc..
Biologiska åtgärder
En studie genomförd 2014 indikerar att brom är en nödvändig kofaktor för biosyntesen av kollagen IV, vilket gör brom till ett väsentligt element för djurvävnadsutveckling. Det finns dock ingen information om konsekvenserna av ett underskott av elementet.
Var finns den
Brom extraheras kommersiellt från saltgruvor och djupa saltlådor som finns i delstaten Arkansas och i Great Salt Lake i Utah, båda i USA. Denna sista saltlösning har en bromkoncentration på 0,5%.
För att extrahera brom tillsättes den heta gasformiga kloren till saltlösningen för att oxidera bromidjonerna i lösningen och samla den elementära bromen..
Döda havet, vid gränsen mellan Jordanien och Israel, är ett stängt hav som ligger under havsnivån, vilket gör att det har en mycket hög koncentration av salter.
Brom och kaliumchlorid erhålls där kommersiellt genom att avdunsta högsaltvattnet från Döda havet. I detta hav kan bromkoncentrationen nå 5 g / l.
Det finns också i höga koncentrationer i vissa varma källor. Brominit är till exempel ett silverbromidmineral som finns i Bolivia och Mexiko..
Risker
Brom i flytande tillstånd är frätande för mänskliga vävnader. Men den största faran för människan kommer från bromångor och deras inandning..
Andas i en miljö med en bromkoncentration på 11-23 mg / m3 orsakar allvarliga stötar. En koncentration på 30-60 mg / m3 det är extremt skadligt. Under tiden kan en koncentration på 200 mg vara dödlig.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Nationellt centrum för bioteknikinformation. (2019). Brom. PubChem-databas. CID = 23968. Återställd från: pubchem.ncbi.nlm.nih.gov
- Ross Rachel. (8 februari 2017). Fakta om brom. Återställd från: livesscience.com
- Wikipedia. (2019). Borax. Återställd från: en.wikipedia.org
- Lenntech B. V. (2019). Brom. Återställd från: lenntech.com


Ingen har kommenterat den här artikeln än.