
Koltetraklorid (CCl4) struktur, egenskaper, användningsområden
De koltetraklorid det är en färglös vätska, med en lätt söt lukt, som liknar lukten av eter och kloroform. Dess kemiska formel är CCl4, och den utgör en kovalent och flyktig förening, vars ånga har större densitet än luft; den är inte en ledare för el och är inte brandfarlig.
Det finns i atmosfären, flodvattnet, havet och sedimenten på den marina ytan. Koltetrakloriden som finns i röda alger tros syntetiseras av samma organism.
I atmosfären produceras den genom reaktion av klor och metan. Industriellt producerad koltetraklorid kommer ut i havet, främst genom gränssnittet mellan hav och luft. Dess atmosfäriska flöde => oceaniska har uppskattats vara 1,4 x 1010 g / år, motsvarande 30% av den totala koltetrakloriden i atmosfären.
Artikelindex
- 1 Huvudfunktioner
- 2 Struktur
- 3 Fysikaliska och kemiska egenskaper
- 4 användningsområden
- 4.1 Kemisk tillverkning
- 4.2 Tillverkning av köldmedier
- 4.3 Brandbekämpning
- 4.4 Rengöring
- 4.5 Kemisk analys
- 4.6 Infraröd spektroskopi och kärnmagnetisk resonans
- 4.7 Lösningsmedel
- 4.8 Andra användningsområden
- 5 Toxicitet
- 5.1 Hepatotoxiska mekanismer
- 5.2 Giftiga effekter på njurarna och centrala nervsystemet
- 5.3 Effekter av exponering hos människor
- 5.4 Giftiga interaktioner
- 6 Intermolekylära interaktioner
- 7 Referenser
Viktigaste egenskaper
Koltetraklorid produceras industriellt genom termisk klorering av metan och reagerar metan med klorgas vid en temperatur mellan 400 ° C och 430 ° C. Under reaktionen alstras en rå produkt med en biprodukt av saltsyra.
Det produceras också industriellt med koldisulfidmetoden. Klor och koldisulfid reageras vid en temperatur av 90 ° C till 100 ° C med användning av järn som katalysator. Därefter utsätts råprodukten för fraktionering, neutralisering och destillation.
CCl4 Det har haft flera användningsområden, bland annat: lösningsmedel för fetter, oljor, lacker osv. kemtvätt av kläder; bekämpningsmedel, jordbruks- och svampdödande gasning och tillverkning av nylon. Trots dess stora användbarhet har dess användning delvis kasserats på grund av den höga toxicitet som den uppvisar..
Hos människor genererar det toxiska effekter på hud, ögon och andningsvägar. Men dess mest skadliga effekter inträffar på funktionen hos centrala nervsystemet, lever och njurar. Njurskador är kanske den främsta dödsorsaken tillskriven den toxiska verkan av koltetraklorid.
Strukturera
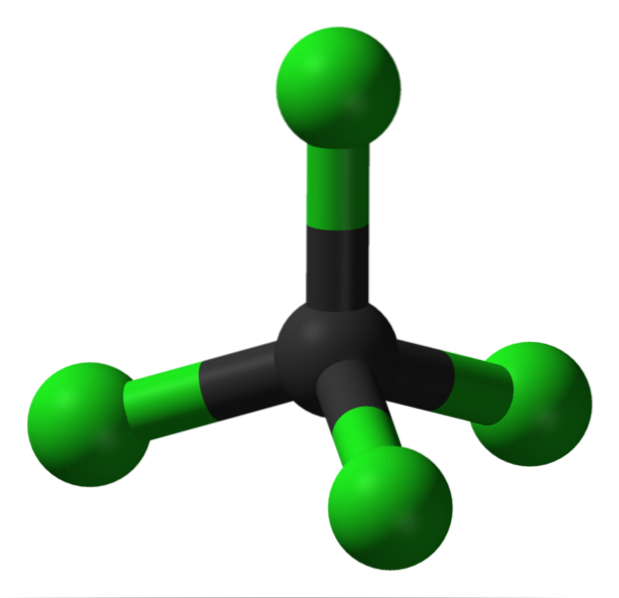
På bilden kan du se strukturen hos koltetraklorid, som har tetrahedral geometri. Observera att Cl-atomerna (de gröna sfärerna) är orienterade i utrymmet runt kolet (svart sfär) och drar en tetraeder.
På samma sätt bör det nämnas att eftersom alla tetraederns hörn är identiska, är strukturen symmetrisk; det vill säga oavsett hur CCl-molekylen roteras4, det kommer alltid att vara detsamma. Så eftersom den gröna tetraedern av CCl4 är symmetrisk resulterar det i frånvaro av ett permanent dipolmoment.
Varför? För även om C-Cl-bindningarna är polära till sin karaktär på grund av den större elektronegativiteten hos Cl med avseende på C, upphävs dessa ögonblick vectorly. Därför är det en apolär klorerad organisk förening..
Kol är helt klorerat i CCl4, vilket är lika med hög oxidation (kol kan bilda högst fyra bindningar med klor). Detta lösningsmedel tenderar inte att förlora elektroner, är aprotiskt (har inga väten) och representerar ett litet transportmedel och lagring av klor..
Fysiska och kemiska egenskaper
Formel
CCl4
Molekylvikt
153,81 g / mol.
Fysiskt utseende
Det är en färglös vätska. Kristalliserar sig i form av monokliniska kristaller.
Odör
Den har den karakteristiska lukten som finns i andra klorerade lösningsmedel. Lukten är aromatisk och något söt, liknar lukten av tetrakloreten och kloroform.
Kokpunkt
76,8 ° C vid 760 mmHg.
Smältpunkt
-9 ºF (-23 ºC).
Vattenlöslighet
Det är dåligt lösligt i vatten: 1,16 mg / ml vid 25 ° C och 0,8 mg / ml vid 20 ° C. Varför? Eftersom vatten, en mycket polär molekyl, inte "känner" affinitet för koltetraklorid, som är icke-polärt..
Löslighet i organiska lösningsmedel
På grund av symmetrin av dess molekylära struktur är koltetraklorid en icke-polär förening. Därför är det blandbart med alkohol, bensen, kloroform, eter, koldisulfid, petroleumeter och nafta. På samma sätt är det lösligt i etanol och aceton..
Densitet
I flytande tillstånd: 1,59 g / ml vid 68 º F och 1,594 g / ml vid 20 ºC.
I fast tillstånd: 1,831 g / ml vid -186 ºC och 1,809 g / ml vid -80 ºC.
Stabilitet
Generellt inert.
Frätande verkan
Angriper vissa former av plast, gummi och beläggningar.
antändningspunkt
Det anses vara lågt brandfarligt, vilket anger antändningspunkten som mindre än 982 ºC.
Självantändning
982 ºC (1800 º F, 1255 K).
Ång-densitet
5.32 i förhållande till luft, taget som ett referensvärde lika med 1.
Ångtryck
91 mmHg vid 68 ° F; 113 mmHg vid 77 ° F och 115 mmHg vid 25 ° C.
Sönderfall
I närvaro av eld bildar det klorid och fosgen, en mycket giftig förening. På samma sätt sönderdelas det under samma förhållanden till väteklorid och kolmonoxid. I närvaro av vatten vid höga temperaturer kan det orsaka saltsyra.
Viskositet
2,03 x 10-3 Pa s
Lukttröskel
21,4 ppm.
Brytningsindex (ηD)
1.4607.
Applikationer
Kemisk tillverkning
-Det intervenerar som kloreringsmedel och / eller lösningsmedel vid tillverkningen av organiskt klor. På samma sätt ingriper det som en monomer vid tillverkningen av nylon..
-Fungerar som lösningsmedel vid tillverkning av gummicement, tvål och insektsmedel.
-Det används vid tillverkning av drivmedlet klorfluorkolväte.
-Eftersom det inte har C-H-bindningar genomgår inte koltetraklorid reaktioner med fria radikaler, vilket gör det till ett användbart lösningsmedel för halogeneringar, antingen genom en elementär halogen eller genom ett halogeneringsreagens, såsom N-bromsuccinimid..
Köldmedietillverkning
Det användes vid framställning av klorfluorkolväte, köldmedium R-11 och triklorfluormetan, köldmedium R-12. Dessa köldmedier förstör ozonskiktet, varför deras användning rekommenderades att upphöra, i enlighet med rekommendationerna i Montrealprotokollet..
Brandbekämpning
I början av 1900-talet började koltetraklorid användas som brandsläckare, baserat på en uppsättning egenskaper hos föreningen: den är flyktig; dess ånga är tyngre än luft; den är inte en elektrisk ledare och är inte särskilt brandfarlig.
När koltetraklorid värms upp blir det till en tung ånga som täcker förbränningsprodukterna, isolerar dem från syret som finns i luften och får branden att släcka. Den är lämplig för att bekämpa olja och apparater.
Vid temperaturer över 500 ºC kan koltetraklorid emellertid reagera med vatten och orsaka fosgen, en giftig förening, så man måste vara uppmärksam på ventilation under användning. Dessutom kan den reagera explosivt med metalliskt natrium, och dess användning i bränder med närvaron av denna metall bör undvikas..
Rengöring
Koltetraklorid har länge använts vid kemtvätt av kläder och andra hushållsmaterial. Dessutom används den som en industriell metallavfettningsmedel, utmärkt för upplösning av fett och olja.
Kemisk analys
Används för detektion av bor, bromid, klorid, molybden, volfram, vanadin, fosfor och silver.
Infraröd spektroskopi och kärnmagnetisk resonans
-Det används som lösningsmedel vid infraröd spektroskopi, eftersom koltetraklorid inte har någon signifikant absorption i band> 1600 cm-1.
-Det användes som lösningsmedel i kärnmagnetisk resonans, eftersom det inte stör tekniken eftersom det inte hade väte (det är aprotiskt). Men på grund av dess toxicitet och dess låga lösningsmedelskraft har koltetraklorid ersatts med deutererade lösningsmedel..
Lösningsmedel
Karakteristiken för att vara en icke-polär förening tillåter användning av koltetraklorid som ett lösningsmedel för oljor, fetter, lacker, lacker, gummivaxer och hartser. Det kan också lösa upp jod.
Andra användningsområden
-Det är en viktig komponent i lavalampor, eftersom koltetraklorid ökar vikten på vaxet på grund av dess densitet..
-Används av frimärkssamlare eftersom det avslöjar vattenstämplar på frimärken utan att orsaka skador.
-Det har använts som bekämpningsmedel och svampdödande medel och vid gasning av korn för att eliminera insekter.
-I metallskärningsprocessen används det som smörjmedel.
-Det har använts i veterinärmedicin som ett ormmedel i behandlingen av fasciolas, orsakad av Fasciola hepatica hos får..
Giftighet
-Koltetraklorid kan absorberas genom andnings-, matsmältnings-, ögon- och hudvägar. Förtäring och inandning är mycket farligt eftersom de kan orsaka allvarliga långvariga skador på hjärnan, levern och njurarna..
-Kontakt med huden orsakar irritation och kan på lång sikt orsaka dermatit. Medan ögonkontakt orsakar irritation.
Hepatotoxiska mekanismer
De viktigaste mekanismerna som producerar leverskador är oxidativ stress och förändring av kalciumhomeostas.
Oxidativ stress är en obalans mellan produktionen av reaktiva syrearter och kroppens förmåga att generera en reducerande miljö, inom dess celler, som styr oxidativa processer..
Obalansen i det normala redoxtillståndet kan orsaka toxiska effekter på grund av produktion av peroxider och fria radikaler som skadar alla komponenter i cellerna..
Koltetraklorid metaboliseras och producerar fria radikaler: Cl3C. (triklorometylradikal) och Cl3KUTTRA. (triklormetylperoxidradikal). Dessa fria radikaler producerar lipoperoxidering, vilket orsakar skador på levern och även lungan.
Fria radikaler orsakar också nedbrytning av plasmamembranet i leverceller. Detta ger en ökning av den cytosoliska kalciumkoncentrationen och en minskning av den intracellulära mekanismen för kalciumbindning..
Ökat intracellulärt kalcium aktiverar enzymet fosfolipas A.två som verkar på fosfolipider i membranet och förvärrar dess påverkan. Dessutom finns det neutrofilinfiltration och hepatocellulär skada. Det finns en minskning av den cellulära koncentrationen av ATP och glutation som orsakar enzyminaktivering och celldöd.
Giftiga effekter på njurarna och centrala nervsystemet
De toxiska effekterna av koltetraklorid manifesteras i njurarna med minskad produktion av urin och kroppens ansamling av vatten. Speciellt i lungorna och en ökning av koncentrationen av metaboliskt avfall i blodet. Detta kan orsaka dödsfall.
På nivån av centrala nervsystemet finns involvering av axonal ledning av nervimpulser.
Effekter av exponering hos människor
Kort varaktighet
Ögonirritation; effekter på levern, njuren och centrala nervsystemet, vilket kan leda till medvetslöshet.
Lång varaktighet
Dermatit och möjlig cancerframkallande verkan.
Giftiga interaktioner
Det finns en koppling mellan många av fallen med koltetrakloridförgiftning och alkoholanvändning. Överdrivet alkoholintag orsakar leverskador, i vissa fall orsakar levercirros.
Toxiciteten för koltetraklorid har observerats öka med barbiturater, eftersom de har några liknande toxiska effekter..
Till exempel, på njurnivå, reducerar barbiturater urinutsöndringen, denna verkan av barbiturater liknar den toxiska effekten av koltetraklorid på njurfunktionen..
Intermolekylära interaktioner
CCl4 det kan betraktas som en grön tetraeder. Hur interagerar du med andra??
Att vara en apolär molekyl, utan permanent dipolmoment, kan den inte interagera genom dipol-dipolkrafter. För att hålla ihop sina molekyler i vätskan måste kloratomerna (tetraederns hörn) interagera med varandra på något sätt; och de gör det tack vare Londons spridningskrafter.
De elektroniska molnen av Cl-atomer rör sig och genererar för korta ögonblick områden som är rika och fattiga av elektroner; det vill säga de genererar omedelbara dipoler.
Den δ- elektronrika zonen får Cl-atomen i en angränsande molekyl att polarisera: Cl5- 5+Cl. Således kan två atomer av Cl hållas tillsammans under en begränsad tid..
Men eftersom det finns miljontals CCl-molekyler4, interaktionerna blir tillräckligt effektiva för att bilda en vätska under normala förhållanden.
Vidare ökar de fyra Cl kovalent kopplade till varje C antalet av dessa interaktioner avsevärt; så mycket att det kokar vid 76,8 ° C, en hög kokpunkt.
Kokpunkten för CCl4 det kan inte vara högre eftersom tetraedrar är relativt små jämfört med andra apolära föreningar (som xylen, som kokar vid 144 ° C).
Referenser
- Hardinger A. Steven. (2017). Illustrerad ordlista för organisk kemi: koltetraklorid. Återställd från: chem.ucla.edu
- Alla Siyavula. (s.f.). Intermolekylära och interatomära krafter. Återställd från: siyavula.com
- Carey F. A. (2006). Organisk kemi. (Sjätte upplagan). Mc Graw Hill.
- Wikipedia. (2018). Koltetraklorid. Återställd från: en.wikipedia.org
- PubChem. (2018). Koltetraklorid. Återställd från: pubchem.ncbi.nlm.nih.gov
- Kemikaliebok. (2017). Koltetraklorid. Återställd från: chemicalbook.com


Ingen har kommenterat den här artikeln än.