
Voltammetri vad den består av, typer och applikationer
De voltammetri Det är en elektroanalytisk teknik som bestämmer information om en kemisk art eller analyt från de elektriska strömmarna som genereras av variationen av en applicerad potential. Det vill säga den applicerade potentialen E (V) och tiden (t) är de oberoende variablerna; medan strömmen (A), den beroende variabeln.
Den kemiska arten måste vanligtvis vara elektroaktiv. Vad betyder det? Det betyder att den måste förlora (oxidera) eller få (minska) elektroner. För att reaktionen ska börja måste arbetselektroden leverera den nödvändiga potential som teoretiskt bestäms av Nernst-ekvationen.
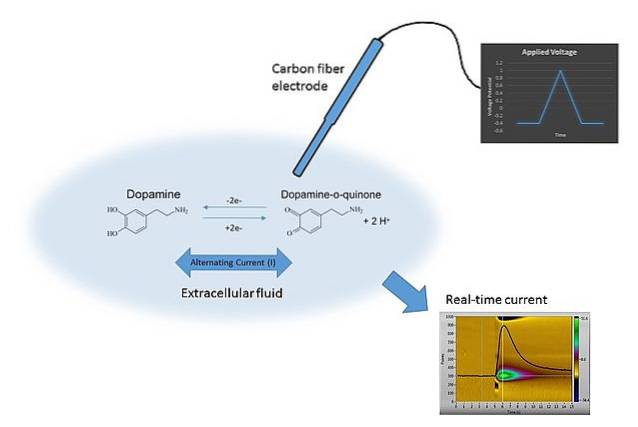
Ett exempel på voltammetri kan ses i bilden ovan. Elektroden i bilden är gjord av kolfibrer, som är nedsänkt i upplösningsmediet. Dopamin oxiderar inte och bildar två karbonylgrupper C = O (höger sida av den kemiska ekvationen) om inte rätt potential används.
Detta uppnås genom att skanna E med olika värden, begränsade av många faktorer såsom lösningen, jonerna närvarande, samma elektrod och dopamin..
Genom att variera E över tiden erhålls två grafer: den första Evt (den blå triangeln) och den andra svaret C vs t (gul). Dess former är karakteristiska för bestämning av dopamin under förhållandena i experimentet..
Artikelindex
- 1 Vad är voltammetri??
- 1.1 Voltammetrisk våg
- 1.2 Instrument
- 2 typer
- 2.1 Puls voltammetri
- 2.2 Upplösning voltammetri
- 3 applikationer
- 4 Referenser
Vad är voltammetri?
Voltammetri utvecklades tack vare uppfinningen av polarografitekniken av Nobelprisvinnaren 1922 i kemi, Jaroslav Heyrovsky. I den förnyas och polariseras elektroden för kvicksilverfallet (EGM).
De analytiska bristerna med denna metod vid den tiden löstes med användning och design av andra mikroelektroder. Dessa varierar enormt i material, från kol, ädelmetaller, diamant och polymerer, till design, skivor, cylindrar, ark; och också på sättet de interagerar med lösningen: stillastående eller roterande.
Alla dessa detaljer är avsedda att gynna polarisationen av elektroden, vilket orsakar en sönderfall av den registrerade strömmen som kallas gränsström (i1). Detta är proportionellt mot analytens koncentration och halva styrkan E (E.1/2) för att nå hälften av nämnda ström (i1/2) är karakteristisk för arten.
Därefter bestämmer du värdena för E.1/2 på kurvan där den erhållna strömmen med variationen av E, kallad voltamperogram, närvaron av en analyt kan identifieras. Det vill säga att varje analyt, med tanke på villkoren för experimentet, kommer att ha sitt eget värde E.1/2.
Voltammetrisk våg
I voltammetri arbetar du med många grafer. Den första av dem är E vs t-kurvan, som gör det möjligt att följa upp de tillämpade potentiella skillnaderna som en funktion av tiden.
Men samtidigt registrerar den elektriska kretsen C-värden som produceras av analyten genom att förlora eller få elektroner i närheten av elektroden..
Eftersom elektroden är polariserad kan mindre analyt diffundera inifrån lösningen in i den. Till exempel, om elektroden är positivt laddad, arten X- kommer att attraheras av det och kommer att gå mot det genom enbart elektrostatisk attraktion.
Men X- Du är inte ensam: det finns andra joner närvarande i din miljö. Vissa katjoner M+ de kan komma i vägen för elektroden genom att stänga den i "kluster" av positiva laddningar; och på samma sätt, N anjoner- kan fastna runt elektroden och förhindra X- Jag kom till honom.
Summan av dessa fysiska fenomen gör att ström går förlorad, och detta observeras i C vs E-kurvan och dess form liknar den hos en S, kallad sigmoidform. Denna kurva är känd som en voltammetrisk våg..
Instrumentation
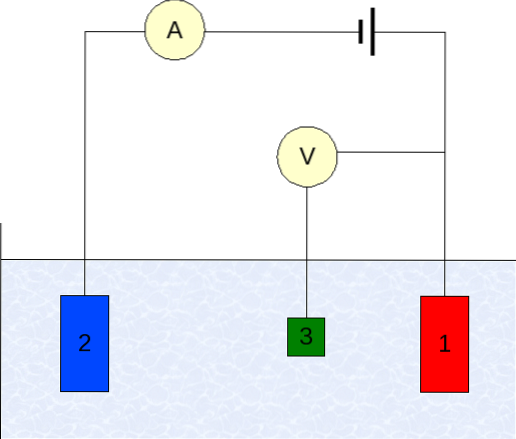
Instrumentet för voltammetri varierar beroende på analyt, lösningsmedel, typ av elektrod och applikation. Men de allra flesta är baserade på ett system som består av tre elektroder: en för arbete (1), hjälp (2) och referens (3)..
Den viktigaste referenselektroden som används är kalomelektroden (ECS). Detta, tillsammans med arbetselektroden, gör det möjligt att fastställa en potentialskillnad AE, eftersom potentialen hos referenselektroden förblir konstant under mätningarna..
Å andra sidan ansvarar hjälpelektroden för att styra laddningen som passerar till arbetselektroden för att hålla den inom acceptabla E-värden. Den oberoende variabeln, den applicerade potentialdifferensen, är den som erhålls genom att addera potentialerna hos arbets- och referenselektroderna..
Typer

Bilden ovan visar en E vs t-graf, även kallad en potentiell våg för en linjär svepvoltammetri..
Man kan se att med tiden ökar potentialen. I sin tur genererar denna svep en svarkurva eller voltamperogram C vs E vars form kommer att vara sigmoid. Det kommer en punkt där oavsett hur mycket E ökar, kommer det inte att bli någon ökning av strömmen.
Andra typer av voltammetri kan härledas från denna graf. Hur? Ändra potentialvåg E mot t genom plötsliga potentialpulser enligt vissa mönster. Varje mönster är förknippat med en typ av voltammetri och omfattar sin egen teori och experimentella förhållanden..
Puls voltammetri
I denna typ av voltammetri kan blandningar av två eller flera analyter vars E-värden analyseras1/2 är mycket nära varandra. Således en analyt med E1/2 på 0,04 V kan identifieras i sällskap med en annan med en E.1/2 av 0,05V. Medan linjär svep voltammetri måste skillnaden vara större än 0,2 V..
Därför finns det högre känslighet och lägre detektionsgränser; dvs analyter kan bestämmas i mycket låga koncentrationer.
Potentialvågor kan ha mönster som liknar trappor, lutande trappor och trianglar. Den senare motsvarar cyklisk voltammetri (CV för dess akronym på engelska, första bilden).
I CV appliceras en potential E i en riktning, positiv eller negativ, och sedan, vid ett visst värde av E vid tid t, appliceras samma potential igen men i motsatt riktning. När man studerar de genererade voltamperogrammen avslöjar de maximala förekomsten av mellanhänder i en kemisk reaktion.
Omlösning voltammetri
Detta kan vara av anodisk eller katodisk typ. Den består av elektrodavsättningen av analyten på en kvicksilverelektrod. Om analyten är en metalljon (såsom Cdtvå+), kommer en amalgam att bildas; och om det är en anjon, (som MoO4två-) ett olösligt kvicksilversalt.
Därefter appliceras potentialpulser för att bestämma koncentrationen och identiteten hos den elektrodeponerade arten. Således är amalgamet återupplöst, som kvicksilversalter.
Applikationer
-Anodisk återupplösning voltammetri används för att bestämma koncentrationen av upplösta metaller i vätska.
-Det gör det möjligt att studera kinetiken för redox- eller adsorptionsprocesser, särskilt när elektroderna modifieras för att detektera en specifik analyt.
-Dess teoretiska grund har använts för tillverkning av biosensorer. Med dessa kan närvaron och koncentrationen av biologiska molekyler, proteiner, fetter, sockerarter etc. bestämmas..
-Slutligen upptäcker den medverkan från mellanhänder i reaktionsmekanismerna.
Referenser
- González M. (22 november 2010). Voltammetri. Återställd från: quimica.laguia2000.com
- Gómez-Biedma, S., Soria, E., & Vivó, M… (2002). Elektrokemisk analys. Journal of Biological Diagnosis, 51 (1), 18-27. Återställd från scielo.isciii.es
- Kemi och vetenskap. (18 juli 2011). Voltammetri. Återställd från: laquimicaylaciencia.blogspot.com
- Quiroga A. (16 februari 2017). Cyklisk voltammetri. Återställd från: chem.libretexts.org
- Samuel P. Kounaves. (s.f.). Voltammetriska tekniker. [PDF]. Tufts University. Återställd från: brown.edu
- Dag R. & Underwood A.. Kvantitativ analytisk kemi (femte upplagan). PEARSON Prentice Hall.



Ingen har kommenterat den här artikeln än.