
Sporfärgningsfaktorer, tekniker och användningsområden

De sporfärgning Det är metoden som används för att färga motståndsstrukturerna som bildar vissa bakterieslag när de är i ogynnsamma förhållanden. dessa strukturer motsvarar en form av överlevnad.
Det finns många släkt som bildar sporer; de viktigaste är dock Bacillus och Clostridium. Dessa släkter anses vara mer relevanta eftersom de har arter som är patogena för människor..
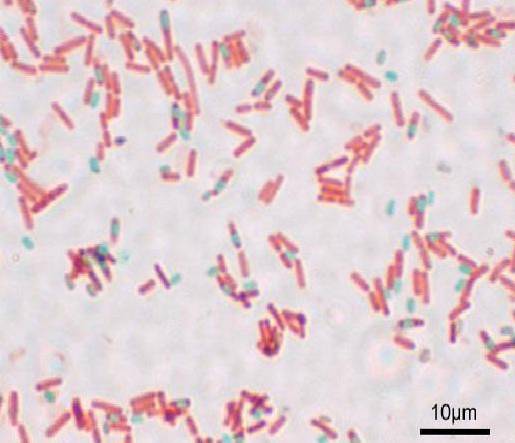
Varje basill kan ge upphov till en spore. Vid tidpunkten för färgning av preparatet kan sporen hittas i bacillus (endospore) eller utanför den (exospore). Med konventionella färgningstekniker för bakterier - så som Gram-fläcken - förblir sporerna färglösa.
För närvarande finns det flera färgningsmetoder som kan penetrera sporans tjocka struktur för att färga den. Dessa metoder är mycket varierande; Dessa inkluderar Dorner-tekniken, Möeller-fläcken och Shaeffer-Fulton-metoden, även känd som Wirtz-Conklin..
Av alla nämnda tekniker är Shaeffer-Fulton-metoden den mest använda i rutinlaboratorier. Det är uppkallat efter två mikrobiologer som skapade färgningen 1930: Alicia Shaeffer och MacDonald Fulton. Men tekniken kallas ibland Wirtz-Conklin för att hedra två bakteriologer från 1900-talet..
Artikelindex
- 1 Motivering
- 2 Sporfärgningstekniker
- 2.1 Dorner-teknik
- 2.2 Modifierad Dorner-teknik
- 2.3 Shaeffer-Fulton eller Wirtz-Conklin teknik
- 2.4 Möellerteknik
- 2.5 Modifierad Möeller-teknik utan värme
- 3 användningsområden
- 3.1 Exempel
- 4 Referenser
Grund
Sporerna fläckar inte med konventionella fläckar eftersom de har en mycket tjock vägg. Sporernas komplexa sammansättning förhindrar inträde av de flesta färgämnen.
Om sporen studeras utifrån och in observeras följande skikt: först är exosporium, som är det tunnaste och yttre skiktet bildat av glykoproteiner.
Därefter kommer nagelbandet, som ger motstånd mot höga temperaturer, följt av cortex som består av peptidoglykan. Senare är basväggen som skyddar protoplasten.
Sporen är en uttorkad struktur som innehåller 15% kalcium och dipikolinsyra. Av denna anledning förlitar sig de flesta sporfärgningstekniker på applicering av värme så att färgämnet kan tränga igenom den tjocka strukturen..
När sporen är färgad kan den inte ta bort färgämnet. I Shaeffer-Fulton-tekniken kommer malakitgrönt in i vegetativa celler och när värme appliceras tränger det in i endosporen och exosporer också..
Genom tvättning med vatten avlägsnas färgämnet från den vegetativa cellen. Detta inträffar eftersom det malakitgröna färgämnet är något grundläggande, så det binder svagt till den vegetativa cellen..
Istället kan den inte komma ut ur sporen och basillen blir så småningom motfärgad med safranin. Denna grund är giltig för resten av teknikerna, där något liknande händer.
Sporfärgningstekniker
För att utföra sporfärgningen måste du ha en ren kultur av den misstänkta stammen du vill studera..
Kulturen utsätts för extrema temperaturer i 24 timmar för att stimulera mikroorganismen att sporulera. För detta kan odlingen placeras i en ugn vid 44 ° C eller i kylskåp (8 ° C) i 24 eller 48 timmar..
Om de lämnas för länge vid de nämnda temperaturerna kommer endast exosporer att observeras, eftersom alla endosporer redan har lämnat basillen.
I slutet av tiden ska några droppar steril fysiologisk lösning placeras på en ren bild. Sedan tas en liten del av kulturen och en fin spridning görs.
Den får sedan torka, värmas och färgas med en av de tekniker som förklaras nedan:
Dorner-teknik
1- Bered en koncentrerad suspension av den sporulerade mikroorganismen i destillerat vatten i ett provrör och tillsätt en lika stor mängd filtrerad Kinyoun carbol fuchsin.
2- Placera röret i ett kokande vattenbad i 5 till 10 minuter.
3- Blanda en droppe av den tidigare suspensionen med en droppe av en 10% vattenhaltig lösning av nigrosin på en ren bild, kokt och filtrerat..
4- Sprid och torka snabbt med mild värme.
5- Undersök med ett 100X-mål (nedsänkning).
Sporer fläckar röda och bakterieceller verkar nästan färglösa mot en mörkgrå bakgrund.
Modifierad Dorner-teknik
1 - En suspension av den sporulerade mikroorganismen sprids på ett objektglas och fixeras i värmen.
2- Provet täcks med en filterpappersremsa till vilken karbolisk fuchsin tillsätts. Färgämnet värms upp i 5 till 7 minuter med Bunsen-brännarens låga tills utvecklingen av ångor genereras. Därefter tas papperet bort.
3- Preparatet tvättas med vatten och torkas sedan med absorberande papper.
4- Täck utstryk med en tunn film av 10% nigrosin, använd en andra bild för att sprida nigrosinet eller en nål.
Färgen som sporer och bakterier tar är densamma som beskrivits i känd teknik.
Shaeffer-Fulton eller Wirtz-Conklin-teknik
1- Gör en fin utstrykning med en suspension av den sporulerade mikroorganismen på ett objektglas och fixera till värme.
2- Täck bilden med 5% vattenlösning av malakgrön (ett filterpapper kan placeras på bilden).
3- Värm över lågan på Bunsen-brännaren så att ångor frigörs och ta bort lågan. Upprepa operationen i 6 till 10 minuter. Om den malakitgröna lösningen avdunstar för mycket under proceduren, mer.
4- Ta bort filterpapperet (om det finns) och tvätta med vatten.
5- Täck bilden med 0,5% vattenhaltigt safranin i 30 sekunder (vissa varianter av tekniken använder 0,1% vattenhaltigt safranin och låt det stå i 3 minuter).
Med denna teknik verkar sporerna gröna och bacillerna röda..
Det har nackdelen att endosporerna hos unga kulturer inte fläckar bra, eftersom de verkar extremt klara eller färglösa. För att undvika detta rekommenderas att man använder kulturer med 48 timmars inkubation..
Möeller teknik
1- Täck utstryk med kloroform i 2 minuter.
2 - Kasta kloroformen.
3- Täck med 5% kromsyra i 5 minuter.
4- Tvätta med destillerat vatten
5- Arket är täckt med carbol fuchsin-fenicada och utsätts för flamman från Bunsenbrännaren tills utsläpp av ångor; sedan avlägsnas den från lågan under några ögonblick. Åtgärden upprepas tills tio minuter är klara.
6- Tvätta med vatten.
7- Använd försurad etanol (saltsyraalkohol) för att missfärga. Låt stå i 20 eller 30 sekunder.
8- Tvätta med destillerat vatten.
9- Kontrastera genom att täcka arket med metylenblått i 5 minuter.
10- Tvätta med destillerat vatten.
11- Låt det torka och ta provet till mikroskopet.
Sporerna verkar röda och bacillerna blå. Det är viktigt att inte andas in ångorna, eftersom de är giftiga och på lång sikt kan vara cancerframkallande..
Värmelös modifierad Möeller-teknik
2007 skapade Hayama och hans medarbetare en modifiering av Möeller-tekniken. De eliminerade steget att värma färgämnet och ersatte det genom att tillsätta 2 droppar av det ytaktiva medlet Tergitol 7 för varje 10 ml karbol-fuchsin-karbol-lösning. Samma resultat erhölls.
Applikationer
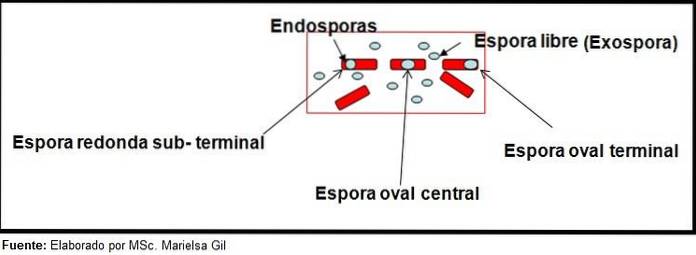
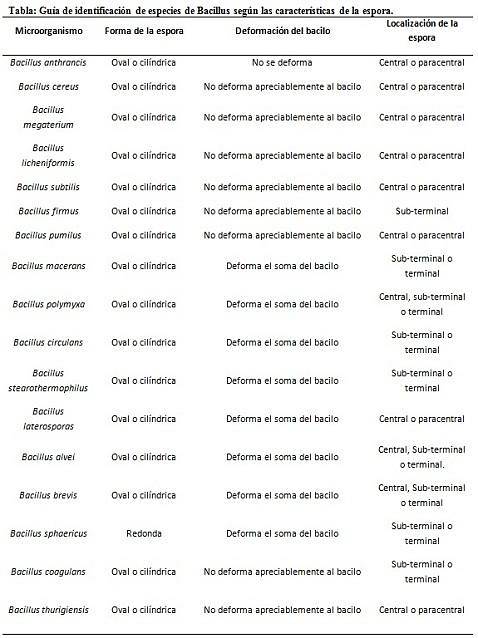
Färgning av sporer ger mycket värdefull och användbar information för identifiering av patogenen, eftersom dess närvaro, dess form, placering i basillen och förmågan att deformera den vegetativa cellen eller inte, är data som kan vägleda arten. viss genre.
I detta sammanhang är det värt att säga att sporerna kan vara runda eller ovala, de kan placeras i mitten eller också i ett paracentralt, subminalt eller terminalläge..
Exempel
- Clostridium difficile bildar en oval spore i terminalläge som deformerar basillen.
- Sporen av Clostridium tertium den är oval, deformerar inte basillen och ligger på terminalnivån.
- Endosporen av Clostridium tetani är terminal och deformerar basillen och ger utseendet på en trumpinne.
- Sporer av Clostridium botulinum, C. histolyticum, C. nybörjare Y C. septicum de är runda eller ovala underterminaler och deformerar basillen.
- Endosporen av Clostridium sordelli är beläget i mittläget, med en lätt deformation.
Referenser
- Hayama M, Oana K, Kozakai T, Umeda S, Fujimoto J, Ota H, Kawakami Y. Förslag om en förenklad teknik för färgning av bakteriesporer utan att applicera värmesuccesfull modifiering av Moellers metod. Eur J Med Res.2007; 16 12 (8): 356-9.
- Wikipedia-bidragsgivare. Moeller fläck. Wikipedia, den fria encyklopedin. 3 november 2018, 03:28 UTC. Tillgänglig på: en.wikipedia.org
- Pérez R, Juárez M, Rodríguez (2011). Laboratoriehandbok för mikrobiologiska tekniker. Institutionen för grundvetenskap Akademi för mikrobiologi. National Polytechnic Institute.
- "Endospore." Wikipedia, den fria encyklopedin. 25 feb 2018, 10:20 UTC. 10 jan 2019, 02:42: en.wikipedia.org
- Silva L, Silva C, Fernández N, Bueno C, Torres J, Rico M, Macías J och medarbetare. (2006). Arbetarpersonal i den autonoma regionen Extremadura. Specifik dagordning Volym IV. MAD Ledare. Sevilla-Spanien, s 211-212.
- Silva M, García M, Corrales J, Ponce E. (2006). Laboratorietekniker, galicisk hälsovård (SERGAS). Specifikt ämnesagenda volym 2. Ledare MAD. Sevilla-Spanien, sid 79-80.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnos. (5: e upplagan). Argentina, Ledare Panamericana S.A.
- Forbes B, Sahm D, Weissfeld A. 2009. Bailey & Scott mikrobiologisk diagnos. 12 utgåva Argentina. Redaktionellt Panamericana S.A


Ingen har kommenterat den här artikeln än.