
Deuteriums struktur, egenskaper och användningsområden
De deuterium är en av de isotopiska vätearterna, som representeras som D eller tvåH. Dessutom har det kallats tungt väte, eftersom dess massa är dubbelt så stor som protonen. En isotop är en art som kommer från samma kemiska element, men vars massnummer skiljer sig från detta.
Denna skillnad beror på skillnaden i antalet neutroner som den har. Deuterium anses vara en stabil isotop och kan hittas i naturligt förekommande väteföreningar, men i en ganska liten andel (mindre än 0,02%).
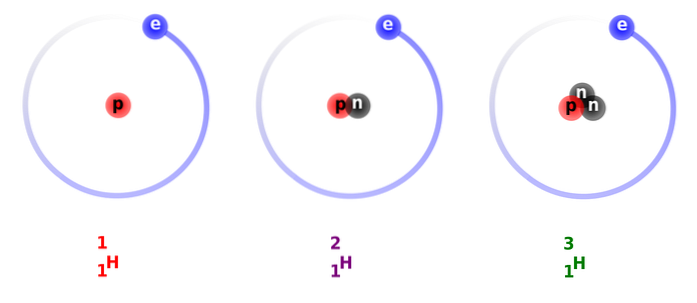
Med tanke på dess egenskaper, som mycket liknar det för vanligt väte, kan det ersätta väte i alla de reaktioner som det deltar i och bli ekvivalenta ämnen..
Av denna och andra skäl har denna isotop ett stort antal applikationer inom olika vetenskapsområden och blir en av de viktigaste.
Artikelindex
- 1 Struktur
- 1.1 Några fakta om deuterium
- 2 fastigheter
- 3 användningsområden
- 4 Referenser
Strukturera
Strukturen hos deuterium består huvudsakligen av en kärna som har en proton och en neutron, med en atomvikt eller massa på ungefär 2014 g.
På samma sätt är denna isotop skyldig sin upptäckt till Harold C. Urey, en kemist från USA, och hans medarbetare Ferdinand Brickwedde och George Murphy, 1931..
På bilden ovan kan du se jämförelsen mellan strukturerna av väteisotoper, som finns i form av protium (dess vanligaste isotop), deuterium och tritium, beställt från vänster till höger.
Beredningen av deuterium i rent tillstånd genomfördes framgångsrikt för första gången 1933, men sedan 1950-talet har en substans i fast fas använts och har visat stabilitet, kallad litiumdeuterid (LiD), för att ersätta deuterium och tritium i en stort antal kemiska reaktioner.
I denna mening har överflödet av denna isotop studerats och det har observerats att dess andel i vatten kan variera något, beroende på källan från vilken provet tas..
Dessutom har spektroskopistudier bestämt förekomsten av denna isotop på andra planeter i denna galax..
Några fakta om deuterium
Som nämnts ovan ligger den grundläggande skillnaden mellan väteisotoper (som är de enda som har nämnts på olika sätt) i deras struktur, eftersom antalet protoner och neutroner i en art ger det dess kemiska egenskaper.
Å andra sidan elimineras deuterium som finns i stjärnkropparna med högre hastighet än det har sitt ursprung.
Dessutom anses det att andra naturfenomen bara utgör en liten mängd av den, så dess produktion fortsätter att generera intresse idag.
På samma sätt har en serie undersökningar visat att de allra flesta atomer som har bildats av denna art har sitt ursprung i Big Bang; detta är anledningen till att dess närvaro märks på stora planeter som Jupiter.
Eftersom det vanligaste sättet att få denna art i naturen är när den finns i kombination med väte i form av protium, fortsätter förhållandet mellan andelen båda arter inom olika vetenskapsområden att väcka vetenskapssamhällets intresse. såsom astronomi eller klimatologi.
Egenskaper
- Det är en isotop som saknar radioaktiva egenskaper; det vill säga det är ganska stabilt till sin natur.
- Den kan användas för att ersätta väteatomen i kemiska reaktioner.
- Denna art visar ett beteende som skiljer sig från vanligt väte i reaktioner av biokemisk natur..
- När de två väteatomerna byts ut i vatten får vi DtvåEller, förvärva namnet på tungt vatten.
- Vätet som finns i havet i form av deuterium finns i en andel av 0,016% i förhållande till protiumet.
- I stjärnor har denna isotop en tendens att smälta snabbt för att ge upphov till helium..
- DtvåO är en giftig art, även om dess kemiska egenskaper är mycket lik Htvå
- När deuteriumatomer utsätts för kärnfusionsprocess vid höga temperaturer frigörs stora mängder energi.
- Fysikaliska egenskaper såsom kokpunkt, densitet, förångningsvärme, trippelpunkt, bland andra, har högre magnituder i deuteriummolekyler (Dtvå) än i väte (Htvå).
- Den vanligaste formen i vilken den finns är bunden till en väteatom och orsakar väte deuterid (HD).
Applikationer
På grund av dess egenskaper används deuterium i en mängd olika applikationer där väte är involverat. Några av dessa användningar beskrivs nedan:
- Inom biokemi används den vid isotopmarkering, som består av att "markera" ett prov med den valda isotopen för att spåra det genom dess passage genom ett specifikt system..
- I kärnreaktorer som utför fusionsreaktioner används den för att minska den hastighet med vilken neutroner rör sig utan den höga absorptionen av dessa som vanligt väte presenterar..
- Inom området kärnmagnetisk resonans (NMR) används lösningsmedel baserade på deuterium för att erhålla prover av denna typ av spektroskopi utan närvaro av störningar som uppstår vid användning av hydrerade lösningsmedel..
- Inom biologin studeras makromolekyler genom neutronspridningstekniker, där prover försedda med deuterium används för att avsevärt minska buller i dessa kontrastegenskaper..
- Inom området farmakologi används substitution av väte mot deuterium på grund av den kinetiska isotopiska effekten som genereras och gör att dessa läkemedel får en längre halveringstid..
Referenser
- Britannica, E. (s.f.). Deuterium. Återställd från britannica.com
- Wikipedia. (s.f.). Deuterium. Hämtad från en.wikipedia.org
- Chang, R. (2007). Chemistry, nionde upplagan. Mexiko: McGraw-Hill.
- Hyperfysik. (s.f.). Deuterium överflöd. Återställd från hyperphysics.phy-astr.gsu.edu
- ThoughtCo. (s.f.). Fakta om deuterium. Hämtad från thoughtco.com



Ingen har kommenterat den här artikeln än.