
Typer av kemiska bindningar

Kemiska bindningar är krafter som håller atomer ihop för att bilda molekylerna. Det finns tre typer av bindningar mellan atomer:
- Metallisk bindning.
- Joniskt band.
- Kovalent bindning: icke-polär, polär, enkel, dubbel, trippel, dativ.
Tack vare dessa bindningar bildas alla föreningar som finns i naturen. Det finns också krafter som håller samman molekyler, så kallade intermolekylära bindningar, såsom:
- Vätebindningar eller bindningar.
- Dipol-dipolkrafter.
Därefter förklarar vi var och en av dessa länkar.
| Typer av kemisk bindning | Karakteristisk | Exempel | |
|---|---|---|---|
| Metall | Metalljoner flyter i ett hav av rörliga elektroner. | Metalliska element: natrium, barium, silver, järn, koppar. | |
| Jonisk | Överföring av elektroner från en atom till en annan. | Natriumklorid Na+Cl- | |
| Kovalent | Icke polär | Dela elektroner lika mellan två atomer. | Molekylärt väte H-H eller Htvå |
| Polär | Dela elektroner ojämnt mellan två atomer. | Vattenmolekyl HtvåELLER | |
| Enkel | Dela ett par elektroner. | Klormolekyl Cltvå Cl-Cl | |
| Dubbel | Dela två par elektroner. | Syremolekyl Otvå O = O | |
| Trippel | Dela tre par elektroner. | Kvävemolekyl N2N eller Ntvå | |
| Dativ | Endast en av atomerna delar elektronerna. | Bindning mellan kväve och bor i föreningen ammoniak-bornrifluorid. | |
| Intermolekylära krafter | Vätebro | Vätemedlen i en molekyl lockas till de elektronegativa atomerna i en annan molekyl. | Vätebindningar mellan vätgas i en vattenmolekyl med syre i en annan vattenmolekyl. |
| Dipol-dipol | Molekyler med två elektriska poler lockar motsatta poler från andra molekyler. | Interaktioner mellan metanala H-molekylertvåC = O | |
Metallisk bindning
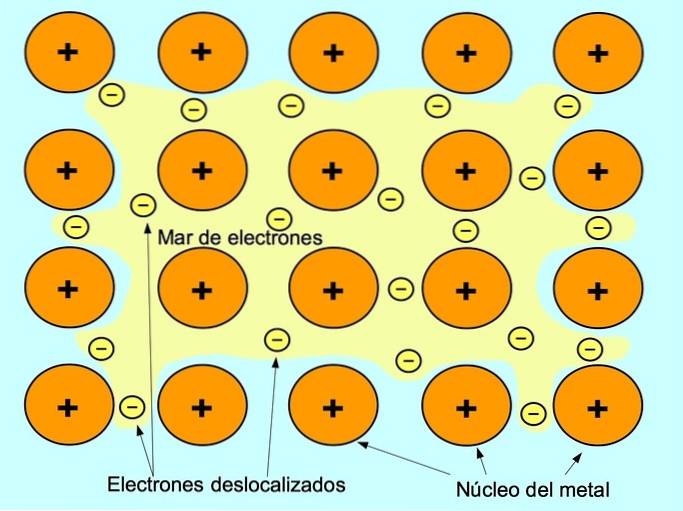
Den metalliska bindningen är attraktionskraften mellan de positiva jonerna i metallelementen och de negativa elektronerna som rör sig fritt mellan jonerna. Metallatomer är tätt packade, detta gör att elektroner kan röra sig inom atomernas gitter.
I metaller frigörs valenselektronerna från sin ursprungliga atom och bildar ett "hav" av elektroner som flyter runt hela metallstrukturen. Detta får metallatomerna att transformeras till positivt laddade metalljoner som packas ihop..
Metallbindningen upprättas mellan metalliska element såsom natrium Na, barium Ba, kalcium Ca, magnesium Mg, guld Au, silver Ag och aluminium Al.
Joniskt band
Den joniska bindningen är den kraft som förenar ett metallelement, såsom natrium eller magnesium, med ett icke-metalliskt element, såsom klor eller svavel. Metallen förlorar elektroner och förvandlas till en positiv metalljon som kallas katjon. Dessa elektroner passerar till det icke-metalliska elementet och det förvandlas till en negativt laddad jon som kallas anjon.
Katjonerna och anjonerna kombinerar och bildar ett tredimensionellt nätverk som upprätthålls av krafterna för elektrostatisk attraktion mellan jonerna med olika laddningar. Dessa krafter bildar jonföreningar.
Jordskorpan består huvudsakligen av jonföreningar. De flesta bergarter, mineraler och ädelstenar är jonföreningar. Till exempel:
- Natriumklorid NaCl: det metalliska elementet är natrium som överför en elektron till klor, vilket är det icke-metalliska elementet.
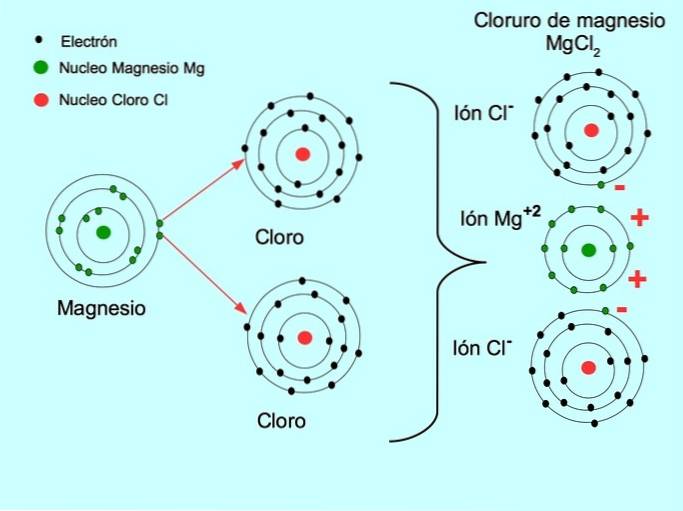
- Magnesiumklorid MgCltvå: Magnesium Mg donerar två elektroner till två kloratomer, som visas i figuren nedan:
Se även Skillnad mellan katjoner och anjoner.
Kovalent bindning
Den kovalenta bindningen bildas när två icke-metalliska atomer delar elektroner. Denna bindning kan vara av flera typer beroende på affiniteten för atomernas elektroner och mängden delade elektroner.
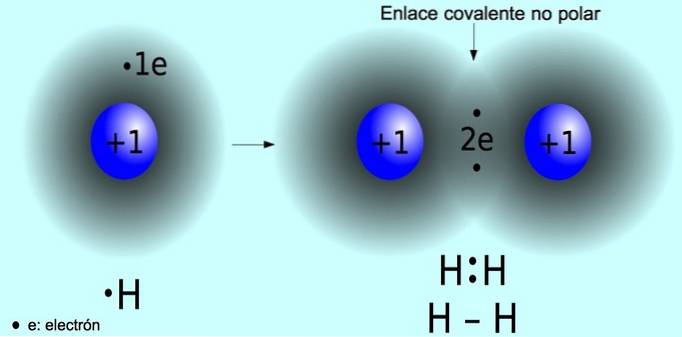
Icke-polär kovalent bindning
Den icke-polära kovalenta bindningen är bindningen som bildas mellan två atomer där elektroner delas lika. Denna bindning förekommer normalt i symmetriska molekyler, det vill säga molekyler som består av två lika atomer, såsom vätemolekylen Htvå och syremolekylen Otvå.
Polär kovalent bindning
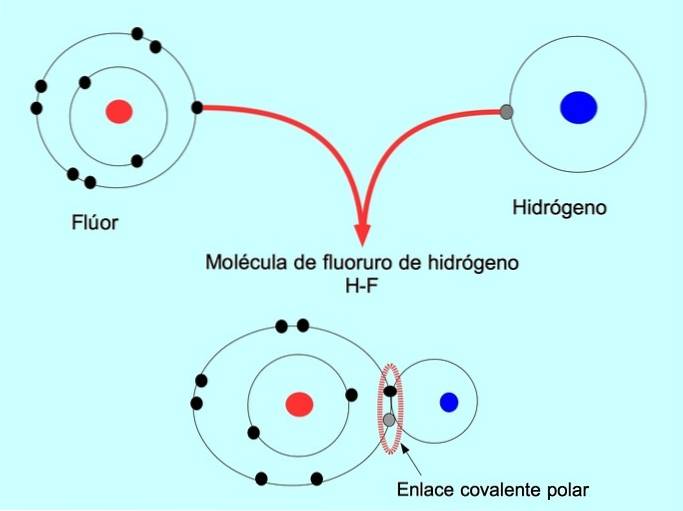
Den polära kovalenta bindningen bildas när två atomer delar elektroner men en av dem har en större attraktion för elektroner. Detta gör att molekylen har en mer negativ "pol" med ett större antal elektroner och den motsatta polen är mer positiv..
Molekyler med denna fördelning eller obalans mellan elektroner kallas polära. Till exempel, i HF-vätefluorid, finns det en kovalent bindning mellan väte och fluor, men fluor har högre elektronegativitet, så det lockar delade elektroner starkare..
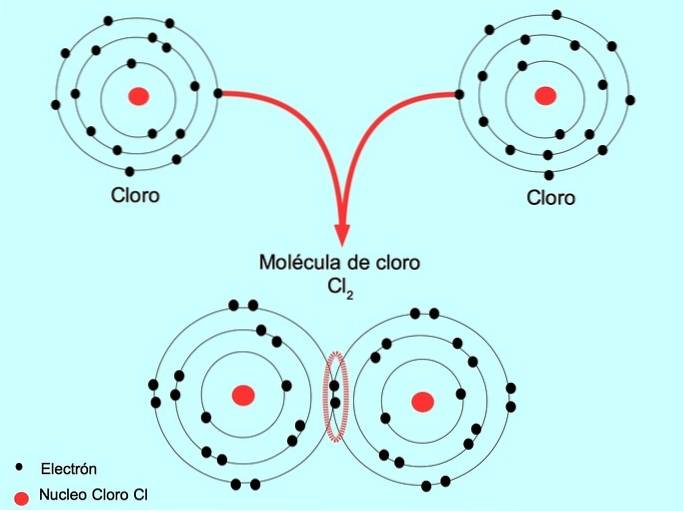
Enkel kovalent bindning
När två atomer delar två elektroner, en från var och en, kallas den bildade kovalenta bindningen en enkel kovalent bindning.
Klor är till exempel en atom som har sju valenselektroner i sitt yttre skal, som kan fyllas med åtta elektroner. Ett klor kan kombineras med ett annat klor för att bilda klormolekylen Cltvå vilket är mycket mer stabilt än enbart klor.
Dubbel kovalent bindning
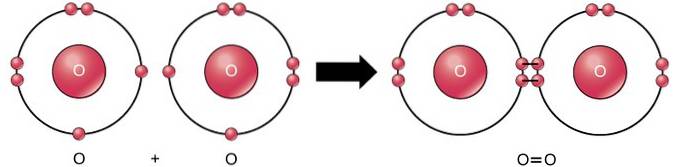
Den dubbla kovalenta bindningen är bindningen där fyra elektroner (två par) elektroner delas mellan två atomer. Till exempel har syre 6 elektroner i sitt sista skal. När två oxygener kombineras delas fyra elektroner mellan de två, vilket får var och en att ha 8 elektroner i det sista skalet..
Trippel kovalent bindning
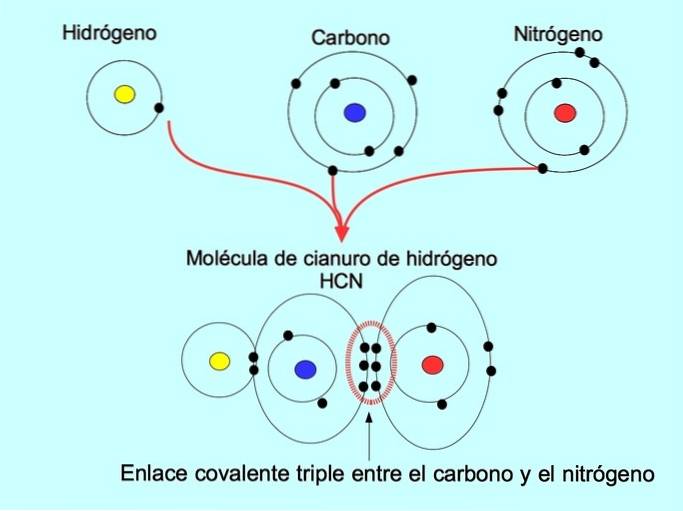
Den tredubbla kovalenta bindningen bildas när 6 elektroner (eller tre par) delas mellan två atomer. Till exempel, i vätecyanidmolekylen HCN, bildas en trippelbindning mellan kol och kväve, såsom visas i figuren nedan:
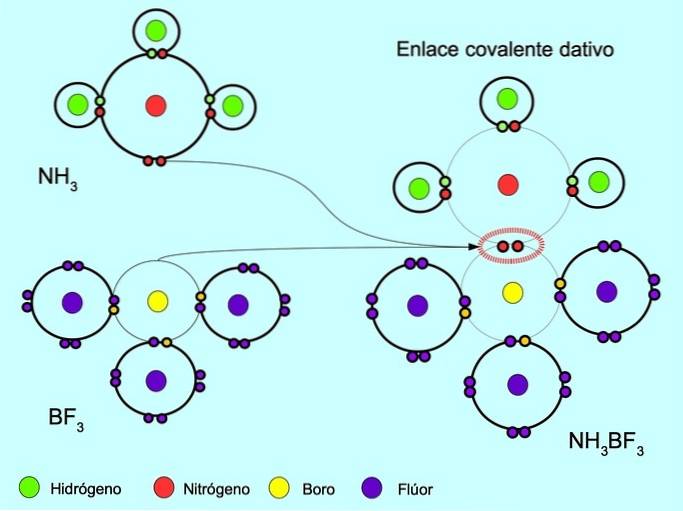
Koordinat eller dativ kovalent bindning
Den koordinerade eller dativa kovalenta bindningen är bindningen som bildas när endast en av atomerna i bindningen bidrar med ett par elektroner. Till exempel när ammoniak NH reagerar3 med bortrifluorid BF3, Kvävebindningar med två elektroner direkt till bor, som inte har några elektroner tillgängliga att dela. På detta sätt finns både kväve och bor kvar med 8 elektroner i sitt valensskal..
Se även organiska och oorganiska föreningar.
Intermolekylära länkar
Molekyler associeras genom krafter som gör det möjligt att bilda ämnen i flytande eller fast tillstånd.
Dipol-dipolbindningar eller krafter
Svaga intermolekylära bindningar kan upprättas mellan polära molekyler när negativa poler lockas till positiva poler och vice versa. Till exempel metanal HtvåC = O är en polär molekyl, med en partiell negativ laddning på syre och en partiell positiv laddning på väten. Den positiva sidan av en metanalmolekyl lockar den negativa sidan av en annan metanalmolekyl.
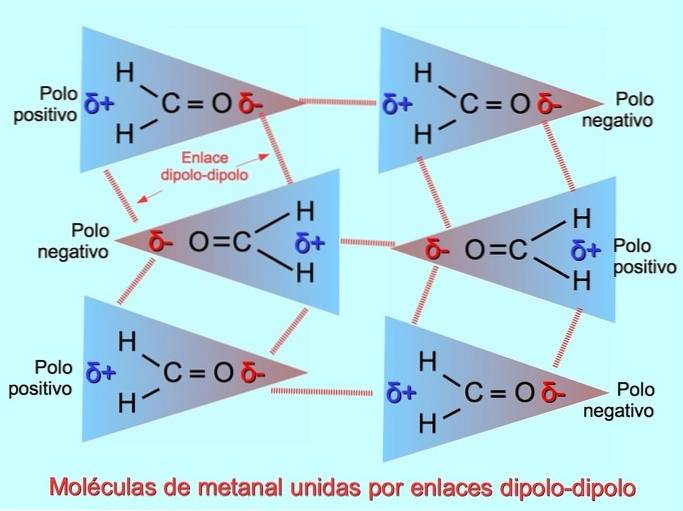
Vätebindningar eller bindningar
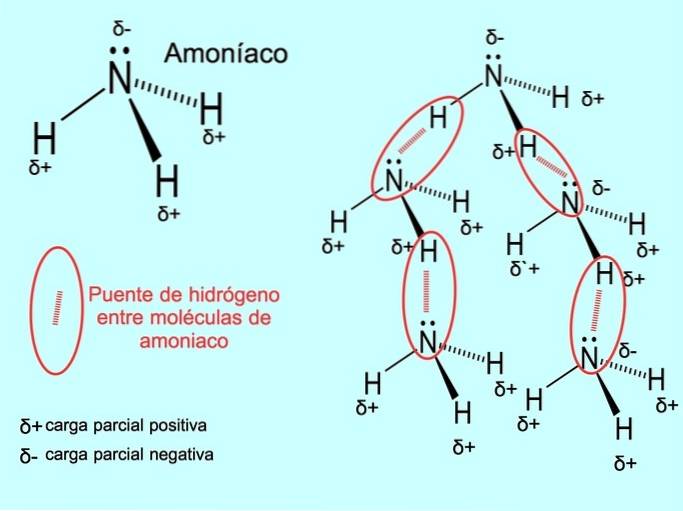
Vätebindningen eller vätebindningen är en bindning som upprättas mellan molekyler. Det inträffar när ett väte i molekylen är kovalent bundet till syre, kväve eller fluor. Syre, kväve och fluor är atomer med högre elektronegativitet, därför attraherar de elektroner starkare när de delar dem med en annan mindre elektronegativ atom..
Det finns vätebindningar mellan vattenmolekyler HtvåO- och NH-ammoniak3 som bilden visar:
Du kanske är intresserad av att se:
- Atomer och molekyler.
- Exempel på organiska och oorganiska föreningar.
Referenser
Zumdahl, S.S., Zumdahl, S.A. (2014) Kemi. Nionde upplagan. Brooks / Cole. Belmont.
Commons, C., Commons, P. (2016) Heinemann Chemistry 1. 5: e upplagan. Pearson Australien. Melbourne.



Ingen har kommenterat den här artikeln än.