
Arseniktrioxid (As2O3) struktur, egenskaper och användningsområden
De arseniktrioxid är en oorganisk förening vars kemiska formel är AstvåELLER3. Arsenik i dess metalliska tillstånd förvandlas snabbt till denna oxid, som är ett mycket giftigt gift som kan ha akuta och kroniska manifestationer..
Eftersom arsenik och syre är element i p-blocket, med en relativt låg elektronegativitetsskillnad, förväntas det atttvåELLER3 består av en kovalent natur; det vill säga att As-O-bindningarna dominerar i sin fasta substans, över de elektrostatiska interaktionerna mellan As-jonerna3+ migtvå-.

Akut berusning med arseniktrioxid uppträder genom intag eller inandning, vars viktigaste manifestationer är: allvarliga mag-tarmsjukdomar, kramper, cirkulationskollaps och lungödem..
Trots dess toxicitet har den dock använts industriellt; till exempel vid bevarande av trä, vid produktion av pigment, halvledare etc. På samma sätt användes det tidigare vid behandling av många sjukdomar.
Arseniktrioxid är en amfoter förening, löslig i utspädda syror och alkalier, olöslig i organiska lösningsmedel och relativt löslig i vatten. Det förekommer som en fast (toppbild), med två kristallina former: kubisk och monoklinisk.
Artikelindex
- 1 Strukturen av arseniktrioxid
- 1.1 Claudetite
- 1.2 Flytande och gasformig
- 1.3 Arsenolit
- 2 fastigheter
- 2.1 Handelsnamn
- 2.2 Molekylvikt
- 2.3 Fysiskt utseende
- 2.4 Lukt
- 2.5 Smak
- 2.6 Kokpunkt
- 2.7 Smältpunkt
- 2.8 Flampunkt
- 2.9 Löslighet i vatten
- 2.10 Löslighet
- 2.11 Densitet
- 2.12 Ångtryck
- 2.13 Sönderfall
- 2.14 Korrosivitet
- 2.15 Förångningsvärme
- 2.16 Dissociationskonstant (Ka)
- 2.17 Brytningsindex
- 3 Reaktivitet
- 4 Nomenklatur
- 5 användningsområden
- 5.1 Industriell
- 5.2 Läkare
- 6 Referenser
Struktur av arseniktrioxid
Claudetita
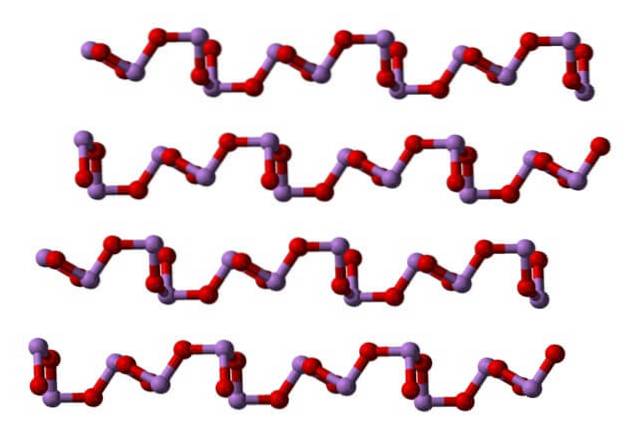
Vid rumstemperatur, AstvåELLER3 kristalliseras till två monokliniska polymorfer, båda finns i mineralet claudetite. De har trigonal pyramidenheter AsO3, som förenas av sina syreatomer för att kompensera för enhetens elektroniska brist.
I en polymorfe AsO-enheterna3 de är länkade och bildar rader (claudetite I), och i den andra är de länkade som om de vävde ett nät (claudetite II):
Flytande och gasformig
När alla dessa strukturer som definierar monokliniska kristaller värms upp, är vibrationerna sådana att flera As-O-bindningar bryts, och en mindre molekyl hamnar rådande: Som4ELLER6. Dess struktur visas i bilden nedan.

Man kan säga att den består av en dimer av AstvåELLER3. Dess stabilitet är sådan att den stöder 800 ° C i gasfasen; men över denna temperatur fragmenteras den i As-molekylertvåELLER3.
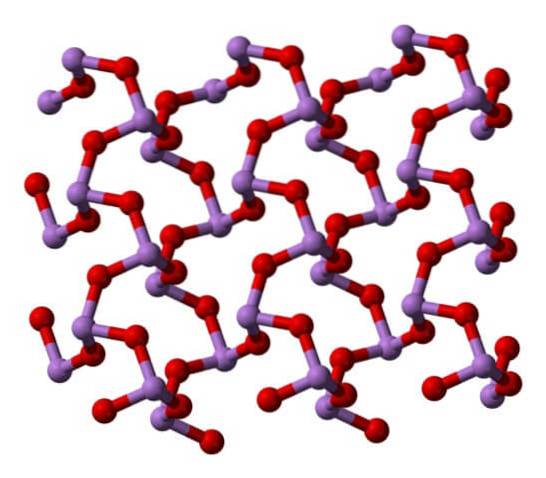
Arsenolit
Samma ess4ELLER6 kan interagera med varandra för att kristallisera till ett kubiskt fast ämne, vars struktur finns i mineralet arsenolit.
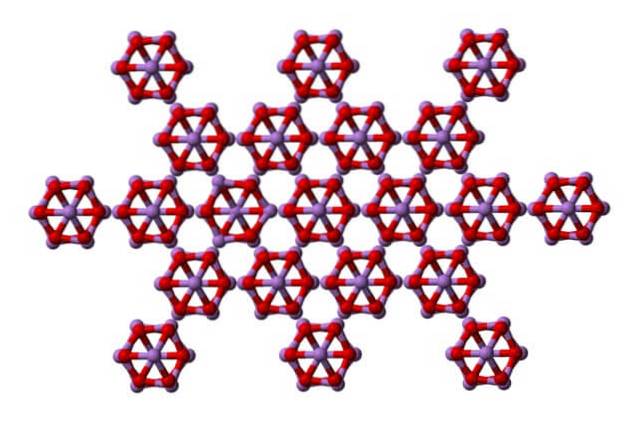
Observera att bilden visar strukturen från ett högre plan. Jämfört med claudetit är dess strukturella skillnad med arsenolit uppenbar. Här är de diskreta molekyler av As4ELLER6 att enheter underhålls av Van der Waals styrkor.
Egenskaper
Handelsnamn
-Arsenolit
-Arsodent
-Trisenox
-Claudetita
Molekylvikt
197,84 g / mol.
Fysiskt utseende
-Vita kubiska kristaller (arsenolit).
-Färglösa monokliniska kristaller (Claudetite).
-Vitt eller genomskinligt fast, glaskropp, amorfa klumpar eller kristallint pulver.
Odör
Toalett.
Smak
Smaklös.
Kokpunkt
460 ºC.
Smältpunkt
-313 ºC (Claudetite).
-274 ºC (Arsenolit).
antändningspunkt
485 º C (sublimat).
Vattenlöslighet
17 g / l vid 18 ºC (20 g / l vid 25 ºC).
Löslighet
Lösligt i syror (särskilt saltsyra) och alkalier. Praktiskt taget olöslig i kloroform och eter.
Densitet
-3,85 g / cm3 (kubiska kristaller);
-4,15 g / cm3 (rombkristaller).
Ångtryck
2,47 10-4 mmHg vid 25 ºC.
Sönderfall
Det är inte brännbart, men vid uppvärmning kan det skapa giftig rök som kan innehålla arsin..
Korrosivitet
I närvaro av fukt kan det vara frätande för metaller.
Förångningsvärme
77 kJ / mol.
Dissociationskonstant (Ka)
1.110-4 vid 25 ºC.
Brytningsindex
-1 755 (arsenolit)
-1.92-2.01 (Claudetite).
Reaktivitet
-Arseniktrioxid är en amfoter förening, men den fungerar företrädesvis som en syra.
-Kan reagera med klorvätesyra eller fluorvätesyra och bilda arseniklorid eller arsenik trifluorid.
-På samma sätt reagerar det med starka oxidationsmedel, såsom salpetersyra, vilket orsakar arseniksyra och dikväveoxid..
-Arseniktrioxid kan reagera med salpetersyra, vilket producerar arsin eller grundämnet arsenik, beroende på reaktionsförhållandena..
EsstvåELLER3 + 6 Zn + 12 HNO3 => 2 AsH3 + 6 Zn (NO3)två + 3 HtvåELLER.
Denna reaktion fungerade som grund för skapandet av Marsh Test, som används för att upptäcka arsenikförgiftning..
Nomenklatur
PåtvåELLER3 Det kan namnges enligt följande nomenklaturer, med vetskap om att arsenik fungerar med valens +3:
-Arsenoxid (traditionell nomenklatur).
-Arsenik (III) oxid (beståndsnomenklatur).
-Diarsenisk trioxid (systematisk nomenklatur).
Applikationer
Industriell
-Det används vid tillverkning av glas, speciellt som blekmedel. Det används också vid tillverkning av keramik, elektroniska produkter och fyrverkerier.
-Det tillsätts som en mindre komponent till kopparbaserade legeringar för att öka korrosionsbeständigheten hos legeringsmetallerna.
-EssettvåELLER3 är utgångsmaterialet för beredning av elementär arsenik, för att förbättra elektriska anslutningar och för produktion av arsenid halvledare
-EssettvåELLER3, såväl som kopparsenat används de som träskyddsmedel. Det användes i kombination med kopparacetat för att göra det gröna pigmentet i Paris, som används för att göra färger och rodenticider..
Läkare
-Arseniktrioxid är en förening som har använts i århundraden vid behandling av många sjukdomar. Det användes som en tonic vid behandling av näringsstörningar, neuralgi, reumatism, artrit, astma, chorea, malaria, syfilis och tuberkulos.
-På samma sätt har det använts vid lokal behandling av hudsjukdomar och har använts för att förstöra vissa ytliga epiteliomer..
-Fowlers lösning användes för att behandla hudsjukdomar och leukemi. Användningen av detta läkemedel avbryts..
-På 1970-talet genomförde den kinesiska forskaren Zhang Tingdong forskning om användningen av arseniktrioxid vid behandling av akut promyelocytisk leukemi (APL). Vilket ledde till produktionen av läkemedlet Trisenox, som godkändes av amerikanska FDA.
-Trisenox har använts hos APL-patienter som inte svarar på "förstahandsbehandling", bestående av alltrans retinsyra (ATRA). Arseniktrioxid har visat sig inducera cancerceller att genomgå apoptos.
-Trisenox används som cytostatika vid behandling av den eldfasta promyelocytiska subtypen (M3) av APL.
Referenser
- Shen et al. (2001). Studier av den kliniska effekten och farmakokinetiken för lågdosarsenoxid vid behandling av återfall akut promyelocytisk leukemi: en jämförelse med konventionell dosering. Leukemi 15, 735-741.
- Science Direct. (2014). Arseniktrioxid. Sevier. Återställd från: sciencedirect.com
- Wikipedia. (2019). Arseniktrioxid. Återställd från: en.wikipedia.org
- PubChem. (2019). Arsenik (III) oxid. Återställd från: pubchem.ncbi.nlm.nih.gov
- Deborah M. Rusta och Steven L. Soignetb. (2001). Risk / nytta-profil för arseniktrioxid. Onkologen vol. 6 Tillägg 2 29-32.
- New England Journal of Medicine. (11 juli 2013). Retinsyra och arseniktrioxid för akut promyelocytisk leukemi. n engl j med 369; 2.

Ingen har kommenterat den här artikeln än.