
Bariumoxid (BaO) struktur, egenskaper, användningsområden, risker

De bariumoxid Det är ett oorganiskt fast ämne bildat av en bariumatom (Ba) och en syreatom (O). Dess kemiska formel är BaO. Det är ett vitt kristallint fast ämne och är hygroskopiskt, det vill säga det absorberar fukt från luften, men när det gör det reagerar det med det..
Den snabba reaktionen av bariumoxid med vatten gör att den används i kemiska analyslaboratorier för att torka ut, det vill säga avlägsna vatten från organiska lösningsmedel, som är flytande föreningar som tjänar till att lösa upp andra ämnen..

BaO beter sig som en stark bas, därför reagerar den med många typer av syror. Reagerar till exempel lätt med koldioxid COtvå från luften för att bilda bariumkarbonat BaCO3.
Det används vid tillverkning av polymerer för kraftkablar och som en ingrediens för hartser för att täta hål i härdade tänder.
Bariumoxid (BaO) används också i keramikindustrin, både för att belägga den med glasyr och för att tillverka den. Det används också i cementblandningar för att öka den slutliga produktens tryckhållfasthet..
Artikelindex
- 1 Struktur
- 2 Nomenklatur
- 3 Fysiska egenskaper
- 3.1 Fysiskt tillstånd
- 3.2 Molekylvikt
- 3.3 Smältpunkt
- 3.4 Kokpunkt
- 3.5 Densitet
- 3.6 Löslighet
- 4 Kemiska egenskaper
- 5 risker
- 6 Erhåller
- 7 användningsområden
- 7.1 Som torkmedel för organiska lösningsmedel
- 7.2 I urladdningslampor
- 7.3 Vid tillverkning av keramik
- 7.4 Vid beredning av cementblandningar
- 7.5 I olika applikationer
- 8 Referenser
Strukturera
Bariumoxid BaO består av en Ba-katjontvå+ och en syreanjon Otvå-.
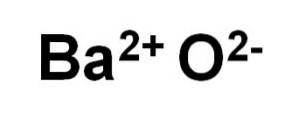
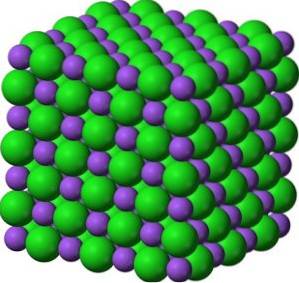
I sina kristaller bildar BaO kubiska joniska nätverk (kubformade) av natriumkloridtyp.
Elektronkonfigurationen för bariumjonen är: [Xe] 6s0 eftersom den har förlorat de två elektronerna i 6s skalet. Denna konfiguration är mycket stabil.
Nomenklatur
-Bariumoxid
-Bariummonoxid
Fysikaliska egenskaper
Fysiskt tillstånd
Gulvitt kristallint fast ämne.
Molekylvikt
153,33 g / mol
Smältpunkt
1923 ºC
Kokpunkt
Cirka 2000 ºC.
Densitet
5,72 g / cm3
Löslighet
Lätt löslig i vatten: 3,8 g / 100 ml vid 20 ºC.
Kemiska egenskaper
Bariumoxid BaO reagerar snabbt med vatten, avger värme och bildar en frätande lösning av bariumhydroxid Ba (OH)två, som är den mest lösliga hydroxiden bland jordalkalimetallhydroxiderna.
BaO + HtvåO → Ba (OH)två
BaO är en stark bas. Reagerar exotermiskt (dvs. med värmeutveckling) med alla typer av syror.
Med COtvå BaO reagerar för att bilda bariumkarbonat BaCO3.
BaO + COtvå → BaCO3
BaO är hygroskopiskt, så om det lämnas exponerat för miljön förenas det lite efter lite med luftfuktigheten och bildar Ba (OH)två som kombineras med koldioxid COtvå från luften för att ge bariumkarbonat BaCO3.
När bariummonoxid BaO värms upp i närvaro av luft kombineras det med syre för att bilda bariumperoxid BaOtvå. Reaktionen är reversibel.
2 BaO + Otvå ⇔ 2 BaOtvå
I närvaro av vatten kan det reagera med aluminium Al eller zink Zn, bilda oxider eller hydroxider av nämnda metaller och alstra vätgas Htvå.
Kan initiera polymerisation av polymeriserbara organiska föreningar, såsom epoxider.
Risker
Kan vara giftigt vid förtäring. Det bör inte komma i kontakt med huden. Det irriterar ögonen, huden och andningsorganen. Det kan vara skadligt för nervsystemet. Det kan orsaka låga kaliumnivåer, vilket resulterar i hjärt- och muskelsjukdomar.
Erhållande
Bariumoxid BaO kan erhållas genom upphettning av bariumkarbonat BaCO3 med kol. BaO bildas och kolmonoxidgas CO frigörs.
Bacchus3 + C → BaO + 2 CO ↑
Applikationer
Som torkmedel för organiska lösningsmedel
På grund av dess lätthet att reagera med vatten har BaO använts sedan mitten av förra seklet som torkmedel för bensin och basiska eller neutrala organiska lösningsmedel..
BaO torkar mycket aktivt runt det, det tar upp fukt mycket snabbt, med utveckling av en hel del värme, vilket bildar bariumhydroxid Ba (OH)två vilket är stabilt upp till cirka 1000 ºC. Av denna anledning kan BaO användas vid höga temperaturer..
Det har också en hög vattenabsorptionsförmåga. För varje BaO-molekyl kan en av vattnet och Ba (OH) absorberastvå resulterande kan också absorbera en viss mängd vatten.
Den är lämplig för analytiska kemilaboratorier. Inte klibbig.
Den kan användas i exsickatorer, som är stora glasbehållare med lock där den inre miljön hålls torr. BaO håller torkarens miniatyratmosfär torr.

Dessa exsickatorer används för att placera ämnen eller reagens och därmed hindra dem från att absorbera vatten från miljön.
Det används också för att torka basiska gaser som NH-ammoniak.3.
I urladdningslampor
BaO placeras på elektroderna i urladdningslampor som ett elektronemitterande material.
Urladdningslampor är gjorda av ett rör av glas, kvarts eller annat lämpligt material, de innehåller en inert gas och i de flesta fall en metallånga. Metallånga kan vara natrium eller kvicksilver.

Elektriska urladdningar sker inuti röret eftersom det har en positiv och en negativ elektrod.
BaO placeras på lampans elektroder. Elektronerna som den avger kolliderar med atomerna i metallens ånga och överför energi till dem..
När en elektrisk ström passerar genom denna gas eller ånga produceras synligt ljus eller ultraviolett (UV) strålning..
Vid tillverkning av keramik
BaO används i kompositioner av keramisk glasbeläggning.

Emellertid har det också testats som tillsatsmedel vid framställning av glaskeramik.
BaO förbättrar effektivt de mekaniska egenskaperna och den kemiska beständigheten hos denna typ av keramik. Det har en stark inverkan på de termiska egenskaperna och sammansättningen av den kristallina fasen av de erhållna materialen..
Vid framställning av cementblandningar
BaO har testats som en komponent i fosfoaluminatcement.
Denna typ av cement är användbar i marina miljöer, eftersom den inte har samma tendens att hydratisera som andra typer av cement, så den lider inte av porbildning eller expansion..
Emellertid måste fosfoaluminatcement förstärkas i sin mekaniska prestanda för att motstå marina strömmar och slag från flytande isbitar som finns i havet..
Tillsatsen av BaO till fosfoaluminatcementen modifierar mineralstrukturen hos nämnda material, förbättrar porstrukturen och ökar cementpastans tryckhållfasthet avsevärt..
Med andra ord förbättrar BaO tryckhållfastheten för denna typ av cement..

I olika applikationer
Det används som en ingrediens för att ge opacitet i tandhartser för att fylla hål i tänderna, utförda av tandläkare.
Det används också som ett kärnbildande medel för framställning av polyvinylidenfluoridpolymerer som används för att isolera kraftkablar..
Referenser
- Partyka, J. et al. (2016). Effekt av tillsats av BaO på sintring av glaskeramiska material från SiOtvå-TilltvåELLER3-NatvåOKEJtvåO-CaO / MgO-system. J Therm Anal Calorim (2016) 125: 1095. Återställd från link.springer.com.
- Zhang, P. et al. (2019). Effekt av BaO på mineralstruktur och hydratiseringsbeteende hos fosfoaluminatcement. J Therm Anal Calorim (2019) 136: 2319. Återställd från link.springer.com.
- USA National Library of Medicine. (2019). Bariumoxid. Återställd från pubchem.ncbi.nlm.nih.gov.
- Smith, N.A. (2003). Belysning. Princip. I Electrical Engineer's Reference Book (sextonde upplagan). Återställd från sciencedirect.com.
- Ebnesajjad, S. (2003). Fluorpolymerskum. Skummande PVDF. I smält bearbetbara fluorplaster. Återställd från sciencedirect.com.
- Booth, H.S. och McIntyre, L.H. (1930). Bariumoxid som dessicant. Ind. Eng. Chem. Anal. Utg. 1930, 2, 1, 12-15. Återställd från pubs.acs.org.



Ingen har kommenterat den här artikeln än.