
Boroxid (B2O3) struktur, egenskaper och användningsområden
De boroxid eller borsyraanhydrid är en oorganisk förening vars kemiska formel är BtvåELLER3. Eftersom bor och syre är element i block p i det periodiska systemet, och ännu fler huvuden för deras respektive grupper, är elektronegativitetsskillnaden mellan dem inte särskilt hög; därför är det att förvänta sig att BtvåELLER3 är kovalent till sin natur.
BtvåELLER3 Den framställs genom upplösning av borax i koncentrerad svavelsyra i en smältugn och vid en temperatur av 750 ° C; termiskt uttorkande borsyra, B (OH)3, vid en temperatur av cirka 300 ° C; eller den kan också bildas som en reaktionsprodukt av diboran (BtvåH6) med syre.

Boroxid kan ha ett halvtransparent glasaktigt eller kristallint utseende; det senare genom slipning kan erhållas i pulverform (övre bild).
Även om det kanske inte verkar så vid första anblicken anses det vara BtvåELLER3 som en av de mest komplexa oorganiska oxiderna; inte bara ur strukturell synvinkel utan också på grund av de variabla egenskaperna som glas och keramik förvärvar till vilka detta läggs till i deras matris.
Artikelindex
- 1 Struktur av boroxid
- 1.1 BO3-enhet
- 1.2 Kristallstruktur
- 1.3 Glasstruktur
- 2 fastigheter
- 2.1 Fysiskt utseende
- 2.2 Molekylär massa
- 2.3 Smak
- 2.4 Densitet
- 2.5 Smältpunkt
- 2.6 Kokpunkt
- 2.7 Stabilitet
- 3 Nomenklatur
- 4 användningsområden
- 4.1 Syntes av bornrihalogenider
- 4.2 Insektsmedel
- 4.3 Lösningsmedel av metalloxider: bildande av glas, keramik och borlegeringar
- 4.4 Bindemedel
- 5 Referenser
Boroxidstruktur
BO-enhet3
BtvåELLER3 är en kovalent fast substans, så i teorin finns det inga B-joner i dess struktur3+ inte heller Otvå-, men B-O länkar. Bor, enligt valensbindningsteorin (TEV), kan endast bilda tre kovalenta bindningar; i detta fall tre B-O-obligationer. Som en konsekvens av detta måste den förväntade geometrin vara trigonal, BO3.
BO-molekylen3 det är elektronbrist, särskilt syreatomer; emellertid kan flera av dem interagera med varandra för att tillhandahålla nämnda brist. Således trianglarna BO3 gå samman genom att dela en syrebro och fördelas i rymden som nätverk av triangulära rader med sina plan orienterade på olika sätt.
Kristallstruktur
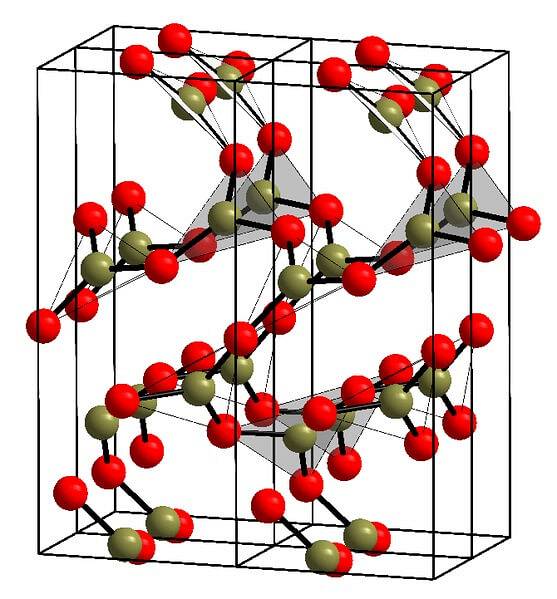
Ett exempel på sådana rader med triangulära enheter BO visas i bilden ovan.3. Om du tittar noga pekar inte alla planernas ansikten mot läsaren utan tvärtom. Orienteringen av dessa ansikten kan vara ansvarig för hur B definierastvåELLER3 vid en viss temperatur och ett visst tryck.
När dessa nätverk har ett långtgående strukturellt mönster är det ett kristallint fast ämne som kan byggas från dess enhetscell. Det är här det sägs att BtvåELLER3 har två kristallina polymorfer: a och β.
A-BtvåELLER3 den produceras vid omgivningstryck (1 atm) och sägs vara kinetiskt instabil; i själva verket är detta en av anledningarna till att boroxid förmodligen är en svårkristalliserad förening.
Den andra polymorfen, β-BtvåELLER3, den erhålls vid höga tryck i GPa-intervallet; därför måste densiteten vara större än den för a-BtvåELLER3.
Glasstruktur
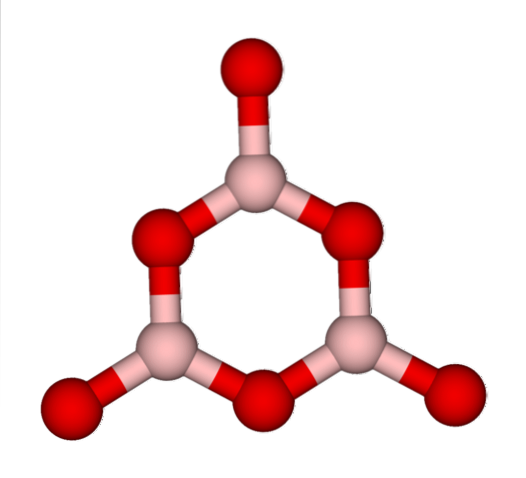
BO-nätverk3 de tenderar naturligtvis att anta amorfa strukturer; Dessa saknar, de saknar ett mönster som beskriver molekylerna eller jonerna i det fasta ämnet. När du syntetiserar BtvåELLER3 dess dominerande form är amorf och inte kristallin; med rätt ord: det är ett fastare glasigare än kristallint.
Det sägs då att BtvåELLER3 det är glaskropp eller amorft när dess BO-nätverk3 de är röriga. Inte bara detta utan de förändrar också sättet de kommer tillsammans på. Istället för att vara ordnade i en trigonal geometri, slutar de länka samman för att skapa vad forskare kallar en boroxolring (toppbild).
Notera den uppenbara skillnaden mellan triangulära och sexkantiga enheter. Trianglar kännetecknar BtvåELLER3 kristallint och sexkantigt till BtvåELLER3 glaskropp. Ett annat sätt att hänvisa till denna amorfa fas är borglas, eller med en formel: g-BtvåELLER3 ('g' kommer från ordet glassy, på engelska).
Således g-B-nätverktvåELLER3 består av boroxolringar och inte BO-enheter3. Emellertid g-BtvåELLER3 kan kristallisera till a-BtvåELLER3, vilket skulle innebära en omvandling av ringar till trianglar, och skulle också definiera graden av kristallisering som uppnåtts.
Egenskaper
Fysiskt utseende
Det är ett färglöst, glasartat fast ämne. I sin kristallina form är den vit.
Molekylär massa
69,6182 g / mol.
Smak
Något bitter
Densitet
-Kristallin: 2,46 g / ml.
-Glaskropp: 1,80 g / ml.
Smältpunkt
Det har inte en fullständigt definierad smältpunkt, eftersom det beror på hur kristallint eller glaskropp det är. Den rent kristallina formen smälter vid 450 ° C; emellertid smälter den glasiga formen i ett temperaturintervall från 300 till 700 ° C..
Kokpunkt
Återigen matchar de rapporterade värdena inte det här värdet. Uppenbarligen kokar flytande boroxid (smält från kristaller eller glas) vid 1860 ° C.
Stabilitet
Det måste hållas torrt eftersom det absorberar fukt för att förvandlas till borsyra, B (OH)3.
Nomenklatur
Boroxid kan namnges på andra sätt, såsom:
-Diborontrioxid (systematisk nomenklatur).
-Bor (III) oxid (beståndsnomenklatur).
-Boroxid (traditionell nomenklatur).
Applikationer
Några av användningarna för boroxid är:
Syntes av bortrihalogenider
Från BtvåELLER3 kan syntetiseras bortrihalogenider, BX3 (X = F, Cl och Br). Dessa föreningar är Lewis-syror, och med dem är det möjligt att införa boratomer i vissa molekyler för att erhålla andra derivat med nya egenskaper..
Insekticid
En fast blandning med borsyra, BtvåELLER3-B (OH)3, representerar en formel som används som hushållsinsekticid.
Lösningsmedel för metalloxider: bildande av glas, keramik och borlegeringar
Flytande boroxid kan lösa metalloxider. Från denna resulterande blandning erhålls fastämnen bestående av bor och metaller när de väl har kylts..
Beroende på mängden BtvåELLER3 används, liksom tekniken, och typen av metalloxid, ett rikt utbud av glas (borosilikater), keramik (bornitrider och karbider) och legeringar (om endast metaller används) kan erhållas.
I allmänhet får glas eller keramik större motståndskraft och hållfasthet och också högre hållbarhet. När det gäller glasögon används de till både optiska och teleskoplinser och för elektroniska apparater..
Pärm
Vid konstruktion av smältugnar av stål används magnesiumbaserade eldfasta tegelstenar. Boroxid används som bindemedel och hjälper till att hålla dem tätt ihop..
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Wikipedia. (2019). Bortrioxid. Återställd från: en.wikipedia.org
- PubChem. (2019). Boroxid. Återställd från: pubchem.ncbi.nlm.nih.gov
- Rio Tinto. (2019). Borixoxid. 20 Mule Team Borax. Återställd från: borax.com
- A. Mukhanov, O. O. Kurakevich och V. L. Solozhenko. (s.f.). På hårdhet av bor (III) oxid. LPMTMCNRS, Université Paris Nord, Villetaneuse, Frankrike.
- Hansen T. (2015). BtvåELLER3 (Boroxid). Återställd från: digitalfire.com


Ingen har kommenterat den här artikeln än.