
Cerium (IV) oxidstruktur, egenskaper, användningsområden

De cerium (IV) oxid u ceriumoxid är en vit eller blekgul oorganisk fast substans som produceras genom oxidation av cerium (Ce) av syre till dess 4+ valens. Den kemiska formeln för ceriumoxid är CeOtvå och är den mest stabila oxiden av cerium.
Cerium (Ce) är ett element i serien av lantanider, som ingår i gruppen sällsynta jordartsmetaller. Den naturliga källan till denna oxid är mineralbastnasiten. I det kommersiella koncentratet av detta mineral CeOtvå kan hittas i en ungefärlig andel av upp till 30 viktprocent.

Vdtvå kan lätt erhållas genom upphettning av cerium (III) hydroxid, Ce (OH) i luft eller syre3, eller något salt av cerium (III), såsom oxalat, karbonat eller nitrat.
Vdtvå Stökiometrisk kan erhållas genom hög temperaturreaktion av cerium (III) oxid med elementärt syre. Syret måste vara i överskott och tillräcklig tid måste tillåtas för att slutföra omvandlingen av de olika icke-stökiometriska faserna som bildas..
Dessa faser omfattar flerfärgade produkter med CeO-formelnx (där x varierar mellan 1,5 och 2,0). De kallas också CeO2-x, där x kan ha ett värde på upp till 0,3. Vdtvå Det är den mest använda formen av Ce i branschen. Det har en låg toxicitetsklassificering, särskilt på grund av dess dåliga löslighet i vatten..

Artikelindex
- 1 Struktur
- 2 Nomenklatur
- 3 fastigheter
- 3.1 Fysiskt tillstånd
- 3.2 Mohs hårdhet
- 3.3 Molekylvikt
- 3.4 Smältpunkt
- 3.5 Densitet
- 3.6 Löslighet
- 3.7 Brytningsindex
- 3.8 Övriga egenskaper
- 4 användningsområden
- 4.1 - Inom metallindustrin
- 4.2 - Inom glasindustrin
- 4.3 - I emaljer
- 4.4 - I zirkoniumoxidkeramik
- 4.5 - I katalysatorer för fordonsutsläppskontroll
- 4.6 - Vid katalys av kemiska reaktioner
- 4.7 - I biologiska och biomedicinska tillämpningar
- 4.8 - Andra användningsområden
- 5 Referenser
Strukturera
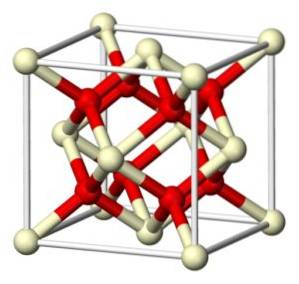
Stökiometrisk cerium (IV) oxid kristalliserar i det fluoritliknande kubiska gitteret (CaFtvå), med 8 O-jonertvå- i en kubisk struktur samordnad med 4 Ce-joner4+.
Nomenklatur
- Cerium (IV) oxid.
- Ceroxid.
- Ceriumdioxid.
- Ceria.
- Stökiometrisk ceriumoxid: material tillverkat helt av CeOtvå.
- Icke-stökiometrisk ceriumoxid: material bildat av blandade oxider från CeOtvå upp till VD1.5
Egenskaper
Fysiskt tillstånd
Ljusgult fast ämne. Färg är känslig för stökiometri och närvaron av andra lantanider. Icke-stökiometriska oxider är ofta blåa.
Mohs hårdhet
6-6.1 ungefär.
Molekylvikt
172,12 g / mol.
Smältpunkt
2600 ºC ungefär.
Densitet
7.132 g / cm3
Löslighet
Olöslig i varmt och kallt vatten. Löslig i koncentrerad svavelsyra och koncentrerad salpetersyra. Olöslig i utspädda syror.
Brytningsindex
2.2.
Andra egenskaper
Vdtvå Det är ett inert ämne, det attackeras inte av starka syror eller alkalier. Den kan emellertid lösas med syror i närvaro av reduktionsmedel, såsom väteperoxid (HtvåELLERtvå) eller tenn (II), bland annat genererande lösningar av cerium (III).
Den har hög termisk stabilitet. Genomgår inte kristallografiska förändringar under vanliga uppvärmningsintervall.
Dess hydratiserade derivat (CeOtvå.nHtvåO) är en gul och gelatinös fällning som erhålls genom att behandla lösningar av cerium (IV) med baser.
Vdtvå det absorberas dåligt från mag-tarmkanalen så det har inga toxiska effekter.
Applikationer
- Inom metallindustrin
Vdtvå används på elektroderna för vissa svetsteknologier, såsom volframbågsvetsning med inert gas.
Oxiden är finfördelad genom volframmatrisen. Vid låga spänningar dessa CeO-partiklartvå ger större tillförlitlighet än volfram ensam.
- Inom glasindustrin
Glaspolering
Ceriumoxid är det mest effektiva polermedlet för de flesta kommersiella glaskompositioner. Vdtvå har nästan helt ersatt andra poleringsoxider, såsom FetvåELLER3, kiseldioxid och ZrOtvå, på grund av dess högre poleringshastighet och rengöring, vilket ökar när renhetsgraden för oxiden ökar.
Kommersiella glaspolerare baserade på ceriumoxidpulver har definierade partikelstorlekar och kontrollerad dispergerbarhet i vattenhaltiga system..
Glaspoleringsprocessen kräver vatten och det som avlägsnas eller reformeras är ett mjukare, hydratiserat ytskikt. Poleringsmedlet bör ha en Mohs-hårdhet på cirka 6,5, nära hårdheten hos de flesta glas.
Ceriumoxid i vatten innehåller Ce (IV) / Ce (III) -paret som med sina oxidationsreduktionsreaktioner kan ge kemisk hjälp under nedbrytningen av glassilikatnätverket.
Vdtvå med hög renhet används den för att behandla speglar, TV-apparater, oftalmiska linser och precisionsoptiskt material.
Missfärgning av glas
Vdtvå kan missfärga sodakalkglas för flaskor, kannor och liknande. Ce (IV) oxiderar Fe (II) föroreningar, som ger en blågrön färg, till Fe (III) vilket ger en tio gånger svagare gul färg.
Strålningsbeständigt glas
Tillsatsen av 1% CeOtvå al glas undertrycker missfärgning eller mörkare av glaset orsakat av bombningen av högenergielektroner i TV-glasögon. Detsamma gäller glas som används i fönster i heta celler inom kärnkraftsindustrin, eftersom det undertrycker gammastrålningsinducerad missfärgning..
Undertryckningsmekanismen antas bero på närvaron av Ce-joner4+ och Ce3+ i glasnätet.
Ljuskänsliga glasögon
Vissa glasformuleringar kan utveckla latenta bilder som sedan kan omvandlas till en permanent struktur eller färg..
Denna typ av glas innehåller CeOtvå som absorberar UV-strålning och släpper ut elektroner i glasmatrisen.
Efter behandling genereras tillväxten av kristaller av andra föreningar i glaset, vilket skapar detaljerade mönster för elektronisk eller dekorativ användning..
- I emaljer
På grund av sitt höga brytningsindex, CeOtvå är ett opacifierande medel i emaljkompositioner som används som skyddande beläggningar på metaller.
Dess höga termiska stabilitet och dess unika kristallografiska form genom hela temperaturområdet som nås under glasprocessen gör den lämplig för användning i porslinemaljer..
I denna ansökan är VDtvå Ger önskad vit beläggning vid emaljutbränning. Det är ingrediensen som ger opacitet.
- I zirkoniumkeramik
Zirkoniumkeramik är en värmeisolator och används i applikationer med hög temperatur. Det kräver en tillsats för att ha hög hållfasthet och seghet. Lägga till CeOtvå Zirkoniumoxid producerar ett material med exceptionell seghet och god beständighet.
CeO-dopad zirkoniumoxidtvå används i beläggningar för att fungera som en termisk barriär på metallytor.
Till exempel i flygmotordelar skyddar dessa beläggningar från de höga temperaturer som metaller skulle utsättas för..
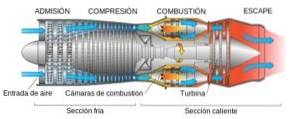
- I katalysatorer för fordonsutsläppskontroll
Vdtvå Det är en aktiv komponent för att avlägsna föroreningar från fordonsutsläpp. Detta beror till stor del på dess förmåga att lagra eller släppa ut syre beroende på förhållandena runt det..
Katalysatorn i motorfordon är placerad mellan motorn och avgasutloppet. Den har en katalysator som måste oxidera oförbrända kolväten, omvandla CO till COtvå, och reducera kväveoxider, NOx, till Ntvå migtvå.

Förutom platina och andra katalytiska metaller är den viktigaste aktiva komponenten i dessa multifunktionella system CeOtvå.
Varje katalysator innehåller 50-100 g CeOtvå finfördelad, vilket tjänar flera funktioner. De viktigaste är:
Fungerar som stabilisator för aluminiumoxid med hög yta
Aluminiumoxid med hög yta tenderar att sintra och förlorar sin höga yta under drift vid hög temperatur. Detta försenas av närvaron av CeOtvå.
Det beter sig som en syrebuffertfrigörare
På grund av dess förmåga att bilda icke-stökiometriska oxider CeO2-x, cerium (IV) -oxid ger elementärt syre med sin egen struktur under syremager / bränslerik cykelperiod.
Således kan oxidationen av oförbrända kolväten som kommer från motorn och omvandlingen av CO till CO fortsätta.två, även när gasformigt syre är otillräckligt.
Under den syrerika cykelperioden tar den upp syret och oxiderar igen och återvinner sin stökiometriska form CeOtvå.
Andra
Det fungerar som en förstärkare av den katalytiska kapaciteten hos rodium vid reduktion av kväveoxider NOx till kväve och syre.
- Vid katalys av kemiska reaktioner
I de katalytiska krackningsprocesserna i raffinaderier, CeOtvå fungerar som en katalytisk oxidant som hjälper till att omvandla SOtvå till SO3 och främjar bildandet av sulfater i specifika fällor i processen.
Vdtvå förbättrar aktiviteten hos den järnoxidbaserade katalysatorn som används för att erhålla styren med utgångspunkt från etylbensen. Detta beror möjligen på den positiva interaktionen mellan oxidreduktionsparen Fe (II) - Fe (III) och Ce (III) - Ce (IV).
- I biologiska och biomedicinska tillämpningar
CeO-nanopartiklar har hittatstvå arbete genom att rensa fria radikaler, såsom superoxid, väteperoxid, hydroxyl och kväveoxidradikal.
De kan skydda biologiska vävnader från strålningsinducerad skada, laserinducerad näthinneskada, öka livscykeln för fotoreceptorceller, minska ryggskador, minska kronisk inflammation och främja angiogenes eller blodkärlsbildning.
Dessutom vissa nanofibrer som innehåller CeO nanopartiklartvå har visat sig vara giftiga mot bakteriestammar och är lovande kandidater för bakteriedödande applikationer.
- Andra användningsområden
Vdtvå Det är ett elektriskt isolerande material på grund av dess utmärkta kemiska stabilitet, höga relativa permittivitet (det har en hög tendens att polarisera när ett elektriskt fält appliceras) och ett kristallint galler som liknar kisel..
Det har funnits tillämpning i kondensatorer och dämpande lager av supraledande material.
Det används också i gassensorer, bränslecellelektrodmaterial i fast oxid, syrepumpar och syrmonitorer..
Referenser
- Cotton, F. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- Bailar, J.C.; Emeléus, H.J.; Sir Ronald Nyholm och Trotman-Dickenson, A.F. (1973). Omfattande oorganisk kemi. Volym 4. Pergamon Press.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Volym 5. Fjärde upplagan. John Wiley & Sons.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Femte upplagan. Volym A6. VCH Verlagsgesellschaft mbH.
- Casals, Eudald et al. (2012). Analys och risk för nanomaterial i miljö- och livsmedelsprover. I omfattande analytisk kemi. Återställd från sciencedirect.com.
- Mailadil T. Sebastian. (2008). Alumina, Titania, Ceria, Silicate, Tungstate och andra material. I dielektriska material för trådlös kommunikation. Återställd från sciencedirect.com.
- Afeesh Rajan Unnithan, et al. (2015). Byggnadsställningar med antibakteriella egenskaper. I nanoteknikapplikationer för vävnadsteknik. Återställd från sciencedirect.com.
- Gottardi V., et al. (1979). Polering av ytan på ett glas undersöktes med kärnteknik. Bulletin of the Spanish Society of Ceramic and Glass, Vol. 18, No. 3. Återställd från boletines.secv.es.

Ingen har kommenterat den här artikeln än.