
Litiumoxidformel, egenskaper, risker och användningar

De litiumoxid Det är en oorganisk kemisk förening med formeln LitvåEller som bildas tillsammans med små mängder litiumperoxid när litiummetall brinner i luft och kombineras med syre..
Fram till 1990-talet dominerades metall- och litiummarknaden av amerikansk produktion från mineralfyndigheter, men i början av 2000-talet härrörde mest produktion från icke-amerikanska källor; Australien, Chile och Portugal var de viktigaste leverantörerna i världen. Bolivia har hälften av litiumfyndigheterna i världen, men det är inte en stor producent.
Den viktigaste kommersiella formen är litiumkarbonat, LitvåCO3, framställts av mineraler eller saltlösning genom flera olika processer.
När litium förbränns i luft är huvudprodukten den vita oxiden av litiumoxid, LitvåO. Dessutom produceras lite litiumperoxid, LitvåELLERtvå, också vit.
Det kan också göras genom termisk sönderdelning av litiumhydroxid, LiOH eller litiumperoxid, Li2O2.
4Li (s) + Otvå(g) → 2LitvåDu)
2LiOH (s) + värme → LitvåO (s) + HtvåO (g)
2LitvåELLERtvå(s) + värme → 2LitvåO (s) + Otvå(g)
Fysiska och kemiska egenskaper
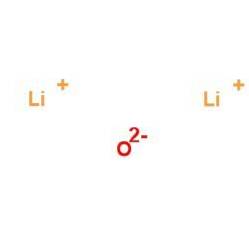
Litiumoxid är ett vitt fast ämne som kallas litia som saknar arom och har en salt smak. Dess utseende visas i figur 2 (National Center for Biotechnology Information, 2017).

Figur 2: utseende av litiumoxid
Litiumoxid är kristaller med antifloritgeometri som liknar natriumklorid (ansiktscentrerad kubik). Dess kristallstruktur presenteras i figur 3 (Mark Winter [University of Sheffield and WebElements Ltd, 2016).
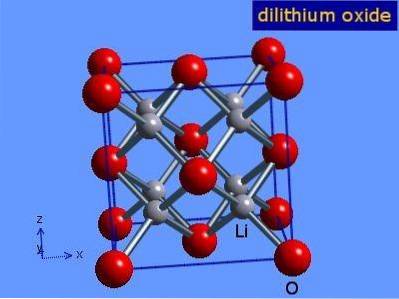
Figur 3: kristallstruktur av litiumoxid.
Dess molekylvikt är 29,88 g / mol, densiteten är 2,013 g / ml och smält- och kokpunkterna är 1438 ° C respektive 2066 ° C. Föreningen är mycket löslig i vatten, alkohol, eter, pyridin och nitrobensen (Royal Society of Chemistry, 2015).
Litiumoxid reagerar lätt med vattenånga för att bilda hydroxid och med koldioxid för att bilda karbonat; därför måste den förvaras och hanteras i en ren och torr atmosfär..
Oxidföreningar leder inte elektricitet. Vissa strukturerade oxider av perovskit är emellertid elektroniska ledare som kan användas i katoden för fasta oxidbränsleceller och syregenereringssystem..
De är föreningar som innehåller minst en syreanjon och en metallkatjon (American Elements, S.F.).
Reaktivitet och faror
Litiumoxid är en stabil förening som är oförenlig med starka syror, vatten och koldioxid. Såvitt vi vet har de kemiska, fysiska och toxikologiska egenskaperna hos litiumoxid inte undersökts noggrant och rapporterats..
Litiumföreningarnas toxicitet är en funktion av deras löslighet i vatten. Litiumjonen har toxicitet i centrala nervsystemet. Föreningen är mycket frätande och irriterande om den kommer i kontakt med ögonen, huden vid inandning eller intag (ESPI METALS, 1993).
Vid kontakt med ögonen, kontrollera om du har kontaktlinser och ta bort dem omedelbart. Ögonen ska spolas med rinnande vatten i minst 15 minuter och håll ögonlocken öppna. Kallt vatten kan användas. Ögonsalva ska inte användas.
Om kemikalien kommer i kontakt med kläder ska du ta bort den så snabbt som möjligt och skydda dina egna händer och kropp. Placera offret under en säkerhetsdusch.
Om kemikalien ansamlas på utsatt hud, t.ex. händer, tvättas den förorenade huden försiktigt och försiktigt med rinnande vatten och icke-slipande tvål. Kallt vatten kan användas. Om irritation kvarstår, kontakta läkare. Tvätta de förorenade kläderna innan du använder dem igen.
Vid inandning ska offret tillåtas vila i ett väl ventilerat område. Om inandning är svår bör offret evakueras till ett säkert område så snart som möjligt..
Lossa trånga kläder som en skjortkrage, bälte eller slips. Om offret har svårt att andas bör syre ges. Om offret inte andas utförs återupplivning från mun till mun.
Tänk alltid på att det kan vara farligt för personen som ger hjälp att ge återupplivning från mun till mun när det inandade materialet är giftigt, smittsamt eller frätande..
I alla fall bör omedelbar läkarvård sökas (SIGMA-ALDRICH, 2010).
Applikationer
Litiumoxid används som ett flöde i keramiska glasyrer och skapar blues med koppar och rosa med kobolt. Litiumoxid reagerar med vatten och ånga för att bilda litiumhydroxid och måste isoleras från dem.
Litiumoxid (LitvåO) med sin höga tritiumpotential är en attraktiv kandidat för det fasta odlingsmaterialet i ett DT-fusionskraftverk på grund av dess höga densitet av litiumatomer (jämfört med andra litium- eller litiummetallkeramik) och dess konduktivitet relativt hög termisk (LITIUMOXID (Li2O), SF).
LitvåEller så kommer den att utsättas för höga temperaturer under neutronbestrålning under drift av smältfilten. Under dessa omständigheter kommer ett stort antal bestrålningsfel att inträffa i LitvåEller såsom heliuminducerad svullnad, relativt hög termisk expansion, korntillväxt, LiOH (T) bildning och nederbörd vid låga temperaturer och LiOH (T) masstransport vid höga temperaturer.
Dessutom har LitvåEller så kommer den att utsättas för spänningar som uppstår på grund av skillnader i termisk expansion mellan LitvåEller och strukturmaterial. Dessa egenskaper hos LitvåEller leda till utmanande tekniska problem inom både filttillverkning och design.
En möjlig ny användning är som ersättning för litiumkobaltoxid som katoden i litiumjonbatterier som används för att driva elektroniska enheter från mobiltelefoner till bärbara datorer samt batteridrivna bilar (Reade International Corp, 2016)..
Referenser
- Mark Winter [University of Sheffield and WebElements Ltd. (2016). webbelement. Hämtad från litium: dilitiumoxid webelements.com.
- Amerikanska element. (S.F.). Litiumoxid. Hämtad från americanelements americanelements.com.
- ESPI METALLER. (1993, juni). Litiumoxid. Hämtad från espimetals espimetals.com.
- LITIUMOXID (Li2O). (S.F.). Hämtad från ferp.ucsd.edu ferp.ucsd.edu.
- Nationellt centrum för bioteknikinformation. (2017, 24 juni). PubChem Compound Database; CID = 166630. Hämtad från PubChem pubchem.ncbi.nlm.nih.gov.
- Reade International Corp. (2016). Litiumoxidpulver (Li2O). Hämtad från reade reade.com
- Royal Society of Chemistry. (2015). Litiumoxid.Hämtad från chemspiderchemspider.com.
- SIGMA-ALDRICH. (2010). Säkerhetsdatablad Litiumoxid. Hämtad från chemblink chemblink.com.


Ingen har kommenterat den här artikeln än.