
Kloroxid (Cl2O7) formel, egenskaper, risker

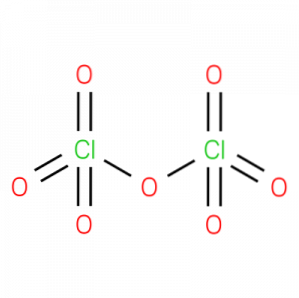
De perkloroxid, även kallad klor (VII) oxid, perklorsyraanhydrid eller diklorheptoxid,är en oorganisk kemisk förening med formeln CltvåO7. Dess struktur presenteras i figur 1.
Det är en av de mest stabila kloroxiderna och reagerar med vatten för att producera perklorsyra: CltvåELLER7 + HtvåO D2HClO4.
Föreningen erhålls genom noggrann uttorkning av perklorsyra med fosforpentoxid vid -10 ° C.
2HClO4 + PtvåELLER5 ”CltvåELLER7 + 2HPO3
Föreningen destilleras för att separera den från metafosforsyra med stor försiktighet med tanke på dess explosiva natur. Det kan också bildas genom belysning i blandningar av klor och ozon.
Fysikaliska och kemiska egenskaper hos kloroxid
Kloroxid (VII) är en färglös, flyktig och oljig vätska. Dess molekylvikt är 182,9 g / mol, densiteten är 1900 kg / m3 och dess smält- och kokpunkter är -91,57 ° C respektive 82 ° C..
Det är spontant explosivt vid stötar eller i kontakt med lågan och särskilt i närvaro av dess sönderdelningsprodukter..
Klorheptoxid löses i koltetraklorid vid rumstemperatur och reagerar med vatten för att bilda perklorsyra. Brister vid kontakt med jod.
Under normala förhållanden är det mer stabilt, men med mindre oxiderande kraft än de andra kloroxiderna. Det attackerar till exempel inte svavel, fosfor eller papper när det är kallt.
Diklorheptoxid är en starkt sur oxid, och i lösning bildar den en jämvikt med perklorsyra. Bildar perklorater i närvaro av alkalimetallhydroxider.
Dess termiska nedbrytning produceras genom monomolekylär dissociation av klortrioxid och radikal
Reaktivitet och faror
Perkloridoxid är en instabil förening. Sönderfaller långsamt vid lagring med produktion av färgade sönderdelningsprodukter som är lägre kloroxider.
Det är spontant explosivt, särskilt i närvaro av dess sönderdelningsprodukter, oförenligt med reduktionsmedel, starka syror och baser..
Även om det är den mest stabila kloroxiden, CltvåELLER7 Det är en stark oxidant, liksom ett explosivt ämne som kan släckas med låga eller mekanisk chock eller genom kontakt med jod..
Det är dock mindre oxiderande än de andra kloroxiderna och det attackerar inte svavel, fosfor eller papper när det är kallt. Har samma effekter på människokroppen som elementärt klor och kräver samma försiktighetsåtgärder
Förtäring orsakar svåra brännskador i munnen, matstrupen och magen. Ånga är mycket giftigt vid inandning.
Vid kontakt med ögonen, kontrollera om du har kontaktlinser och ta bort dem omedelbart. Ögonen ska spolas med rinnande vatten i minst 15 minuter och håll ögonlocken öppna. Kallt vatten kan användas. Ögonsalva ska inte användas.
Om kemikalien kommer i kontakt med kläder ska du ta bort den så snabbt som möjligt och skydda dina egna händer och kropp. Placera offret under en säkerhetsdusch.
Om kemikalien ansamlas på utsatt hud, t.ex. händer, tvättas den förorenade huden försiktigt och försiktigt med rinnande vatten och icke-slipande tvål..
Kallt vatten kan användas. Om irritation kvarstår, kontakta läkare. Tvätta de förorenade kläderna innan du använder dem igen.
Vid inandning ska offret tillåtas vila i ett väl ventilerat område. Om inandning är svår bör offret evakueras till ett säkert område så snart som möjligt..
Lossa trånga kläder som en skjortkrage, bälte eller slips. Om offret har svårt att andas bör syre ges.
Om offret inte andas utförs återupplivning från mun till mun. Tänk alltid på att det kan vara farligt för personen som ger hjälp att ge återupplivning från mun till mun när det inandade materialet är giftigt, smittsamt eller frätande..
Sök alltid läkare omedelbart.
Applikationer
Kloroxid har inga praktiska tillämpningar. Det kan användas som ett oxidationsmedel eller för produktion av perklorsyra men dess explosiva natur gör det svårt att hantera.
Diklorheptoxid kan användas som ett reagens för produktion av perklorater eller för studier med olika reaktioner.
I arbetet med Kurt Baum, reaktionerna av perkloroxid med olefiner (Baum, 1976), alkoholer (Kurt Baum, Reaktioner av diklorheptoxid med alkoholer, 1974), alkyljodider och acylperklorat med ester (Kurt Baum, 1975) som erhåller halogeneringar och oxidationer.
När det gäller alkoholer producerar den alkylperklorater genom att reagera med enkla alkoholer, såsom etylenglykol, 1,4-butadienol, 2,2,2-trifluoroetanol, 2,2-dinitropropanol. Reagerar med 2-propanol för att ge isopropylperklorat. 2-hexanol och 3-hexanol ger oadresserade perklorater och deras respektive ketoner.
Propen reagerar med diklorheptosid i koltetraklorid för att ge isopropylperklorat (32%) och 1-klor, 2-propylperklorat (17%). Föreningen reagerar med cis-buten för att ge 3-klorbutylperklorat (30%) och 3-keto, 2-butylperklorat (7%).
Dikloroheptoxid reagerar med primära och sekundära aminer i koltetrakloridlösning för att ge N-perklorater:
2 RNH2 + Cl207 → 2 RNHCl03 + H2O
2 R2NH + Cl207 → 2 R2NCl03 + H2O
Det reagerar också med alkener för att ge alkylperklorater. Till exempel reagerar den med propen i koltetrakloridlösning för att producera isopropylperklorat och 1-klor-2-propylperklorat (Beard & Baum, 1974)..
Referenser
- Baum, K. (1976). Reaktioner av diklorheptoxid med olefiner. Org. Chem. 41 (9) , 1663-1665.
- Beard, C. D., & Baum, K ... (1974). Reaktioner av diklorheptoxid med aminer. Journal of American Chemical Society. 96 (10), 3237-3239.
- Egon Wiberg, N. W. (2001). Oorganisk kemi. Academic Press: London.
- EMBL-EBI. (2009, 25 april). diklorheptaoxid. Hämtad från ChEBI: ebi.ac.uk.
- Kurt Baum, C. D. (1974). Reaktioner av diklorheptoxid med alkoholer. Am. Chem. Soc., 96 (10), 3233-3237.
- Kurt Baum, C. D. (1975). Reaktioner mellan diklorheptoxid och acylperklorater med etrar. Org. Chem., 40 (1) , 81-85.
- Kurt Baum, C. D. (1975). Reaktioner mellan diklorheptoxid och hypohaliter med alkyljodider. Org. Chem., 40 (17), 2536-2537.
- Royal Society of Chemistry. (2015). Diklorheptoxid. Hämtad från chemspider: chemspider.com.



Ingen har kommenterat den här artikeln än.