
50 Exempel på syror och baser

Det finns hundratals exempel på syror och baser som finns i alla kemiska grenar, men som i sin helhet är uppdelade i två stora familjer: oorganiska och organiska. Oorganiska syror är vanligtvis kända som mineralsyror, som kännetecknas av att de är särskilt starka jämfört med organiska..
Syror och baser förstås som ämnen som har sura eller saponaceous smaker. Båda är frätande, även om ordet "frätande" ofta används för starka baser. Slutsats: de bränner och fräter ut huden vid beröring. Dess egenskaper i upplösande media har styrt en rad definitioner genom historien..
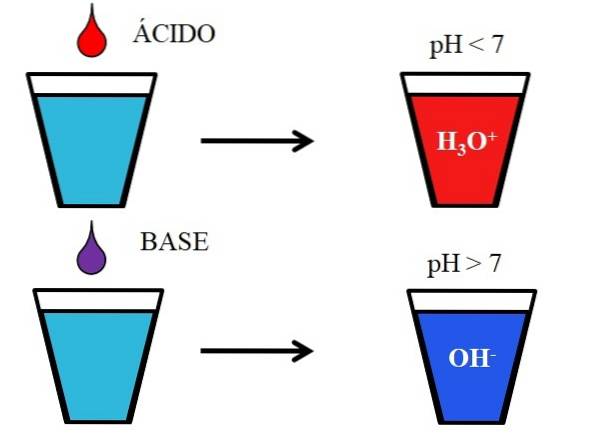
Bilden nedan visar det generiska beteendet hos syror och baser när de tillsätts eller löses i ett glas vatten. Syror producerar lösningar med pH-värden under 7 på grund av hydroniumjoner, H3ELLER+; medan baserna producerar lösningar med ett pH över 7 på grund av hydroxyl- (eller hydroxyl-) jonerna, OH-.
Om vi lägger till saltsyra, HCl (röd droppe) till glaset, kommer det att finnas H-joner3ELLER+ och Cl- hydratiserad. Å andra sidan, om vi upprepar experimentet med natriumhydroxid, NaOH (lila droppe), kommer vi att ha OH-joner- och Na+.
Artikelindex
- 1 Definitioner
- 1.1 Arrhenius
- 1.2 Bronsted-Lowry
- 1.3 Lewis
- 2 Exempel på syror
- 3 Exempel på baser
- 4 Referenser
Definitioner

De alltmer studerade och förståda egenskaperna hos syror och baser skapade mer än en definition för dessa kemiska föreningar. Bland dessa definitioner har vi Arrhenius, Bronsted-Lowrys och slutligen Lewis. Innan du citerar exemplen är det nödvändigt att vara tydlig om detta.
Arrhenius
Syror och baser, enligt Arrhenius, är de som, när de löses i vatten, producerar H-joner3ELLER+ eller OH-, respektive. Det vill säga bilden representerar redan denna definition. Men i sig själv försummar det vissa syror eller baser som är för svaga för att producera sådana joner. Det är här Bronsted-Lowry-definitionen kommer in..
Bronsted-Lowry
Bronsted-Lowry-syror är de som kan donera H-joner+, och baserna är de som accepterar dessa H+. Om en syra mycket enkelt donerar sin H+, betyder att det är en stark syra. Detsamma händer med baserna, men att acceptera H+.
Således har vi starka eller svaga syror och baser, och deras krafter mäts i olika lösningsmedel; särskilt i vatten, från vilket de kända pH-enheterna är etablerade (från 0 till 14).
Därför kommer en stark syra HA att helt donera din H+ till vatten i en reaktion av typen:
HA + HtvåO => A- + H3ELLER+
Vart?- är den konjugerade basen av HA. Därför kommer H3ELLER+ närvarande i glaset med syralösning.
Under tiden kommer en svag bas B att deprotonera vattnet för att få sin respektive H+:
B + HtvåELLER <=> HB + OH-
Där HB är den konjugerade syran av B. Detta är fallet med ammoniak, NH3:
NH3 + HtvåELLER <=> NH4+ + Åh-
En mycket stark bas kan direkt donera OH-joner- utan att behöva reagera med vatten; precis som NaOH.
Lewis
Slutligen är Lewis-syror de som får eller accepterar elektroner, och Lewis-baser är de som donerar eller förlorar elektroner..
Till exempel Bronsted-Lowry NH-basen3 Det är också en Lewis-bas, eftersom kväveatomen accepterar en H+ genom att donera sitt par fria elektroner (H3N: H+). Det är därför de tre definitionerna inte är oeniga med varandra utan snarare sammanflätar och hjälper till att studera surhet och basitet i ett bredare spektrum av kemiska föreningar..
Exempel på syror
Efter att ha förtydligat definitionerna kommer en serie syror med deras respektive formler och namn att nämnas nedan:
-HF: fluorvätesyra
-HBr: bromvätesyra
-HI: hydrojodsyra
-HtvåS: vätesulfid
-HtvåSe: selenvätesyra
-HtvåTe: tellursyra
Dessa är de binära syrorna, även kallade saltsyror, till vilka ovannämnda saltsyra, HCl tillhör.
-HNO3: salpetersyra
-HNOtvå: salpetersyra
-HNO: hyponitrös syra
-HtvåCO3: kolsyra
-HtvåCOtvå: kolhaltig syra, som faktiskt är bättre känd under namnet myrsyra, HCOOH, den enklaste organiska syran av alla
-H3PO4: fosforsyra
-H3PO3 eller Htvå[HPO3]: fosforsyra, med en HP-bindning
-H3POtvå eller H [HtvåPOtvå]: hypofosforsyra, med två HP-bindningar
-HtvåSW4: svavelsyra
-HtvåSW3: svavelsyra
-HtvåStvåELLER7: svavelsyra
-HIO4: periodisk syra
-HIO3: jodsyra
-HIOtvå: jodsyra
-HIO: hypojodsyra
-HtvåCrO4: kromsyra
-HMnO4: mangansyra
-CH3COOH: ättiksyra (vinäger)
-CH3SW3H: metansulfonsyra
Alla dessa syror, utom myran och de två sista, är kända som oxacids eller ternära syror..
Andra:
-AlCl3: aluminiumklorid
-FeCl3: järnklorid
-BF3: bortrifluorid
-Metallkatjoner upplösta i vatten
-Carbocations
-H (CHBelvaClelva): supersyra karboran
- FSO3H: fluorsulfonsyra
- HSbF6: fluoroantimonsyra
- FSO3H SbF5: magisk syra
De sista fyra exemplen utgör de fruktansvärda supersyrorna; föreningar som kan sönderdelas nästan vilket som helst material bara genom att röra vid det. AlCl3 är ett exempel på Lewis-syra, eftersom metallcentret i aluminium kan acceptera elektroner på grund av dess elektroniska brist (det slutför inte sin valensoktet).
Exempel på baser
Bland de oorganiska baserna har vi metallhydroxider, såsom natriumhydroxid, och vissa molekylära hydrider, såsom ammoniak som redan nämnts. Här är andra exempel på baser:
-KOH: kaliumhydroxid
-LiOH: litiumhydroxid
-RbOH: rubidiumhydroxid
-CsOH: cesiumhydroxid
-FrOH: franciumhydroxid
-Be (OH)två: berylliumhydroxid
-Mg (OH)två: magnesiumhydroxid
-Ca (OH)två: kalcium hydroxid
-Sr (OH)två: strontiumhydroxid
-Ba (OH)två: bariumhydroxid
-Ra (OH)två: radiumhydroxid
-Fe (OH)två: järnhydroxid
-Fe (OH)3: järnhydroxid
-Al (OH)3: aluminiumhydroxid
-Pb (OH)4: blyhydroxid
-Zn (OH)två: zinkhydroxid
-Cd (OH)två: kadmiumhydroxid
-Cu (OH)två: kopparhydroxid
-Ti (OH)4: titanhydroxid
-PH3: fosfin
-Aska3: arsine
-NaNHtvå: natriumamid
- C5H5N: pyridin
-(CH3N: trimetylamin
- C6H5NHtvå: fenylamin eller anilin
-NaH: natriumhydrid
-KH: kaliumhydrid
-Carbanions
-Li3N: litiumnitrid
-Alkoxider
-[(CH3)tvåCH]tvåNLi: litiumdiisopropylamid
-Dietynylbensenanjon: C6H4C4två- (den starkaste basen hittills känd)
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Naomi Hennah. (10 oktober 2018). Hur man lär ut syror, baser och salter. Återställd från: edu.rsc.org
- Helmenstine, Anne Marie, Ph.D. (31 augusti 2019). Formler för vanliga syror och baser. Återställd från: thoughtco.com
- David Wood. (2019). Jämföra vanliga syror och baser. Studie. Återställd från: study.com
- Ross Pomeroy. (23 augusti 2013). Världens starkaste syror: som eld och is. Återställd från: realclearscience.com
- Wikipedia. (2019). Diethynylbensen dianion. Återställd från: en.wikipedia.org



Ingen har kommenterat den här artikeln än.