
Absorbera vad det är, exempel och lösta övningar
De absorbans är logaritmen med ett negativt tecken på kvoten mellan den framväxande ljusintensiteten och den infallande ljusintensiteten på ett prov av genomskinlig lösning som har belysts med monokromatiskt ljus. Denna kvot är transmittans.
Den fysiska processen för passage av ljus genom ett prov kallas ljustransmission, och absorbansen är ett mått på den. Följaktligen blir absorbansen den minsta logaritmen för transmittansen och är en viktig data för att bestämma koncentrationen av ett prov som i allmänhet är löst i ett lösningsmedel såsom vatten, alkohol eller något annat..
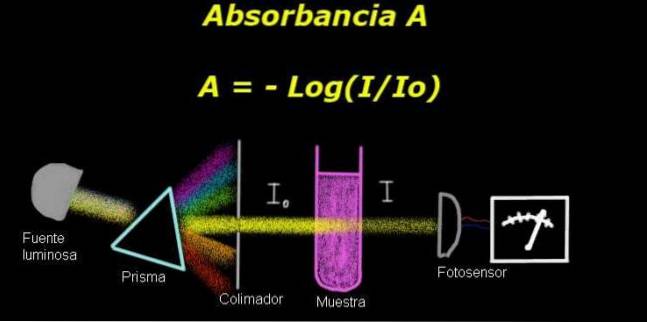
För att mäta absorbansen behöver du en anordning som kallas elektrofotometer, med vilken en ström som är proportionell mot den infallande ljusintensiteten på dess yta mäts.
Vid beräkning av transmittans mäts vanligtvis först intensitetssignalen som motsvarar lösningsmedlet och detta resultat registreras som Io.
Därefter placeras det upplösta provet i lösningsmedlet under samma ljusförhållanden. Signalen som mäts av elektrofotometern betecknas som Jag, som gör det möjligt att beräkna transmittansen T enligt följande formel:
T = jag / jageller
Det är en måttlös kvantitet. De absorbans A uttrycks således som:
A = - log (T) = - log (I / Ieller)
Artikelindex
- 1 Molar absorbans och absorptionsförmåga
- 1.1 Beer-Lamberts lag
- 2 Exempel
- 2.1 Exempel 1
- 2.2 Exempel 2
- 3 Lösta övningar
- 3.1 Övning 1
- 3.2 Övning 2
- 3.3 Övning 3
- 4 Referenser
Molar absorbans och absorptionsförmåga
Molekylerna som utgör en kemisk substans kan absorbera ljus, och ett mått på detta är exakt absorbans. Det är resultatet av interaktionen mellan fotoner och molekylära elektroner.
Därför är det en storlek som beror på densiteten eller koncentrationen av molekylerna som utgör provet och även på den optiska vägen eller sträckan som ljuset har rest..
Experimentella data indikerar att absorbansen TILL är linjärt proportionellt mot koncentrationen C och på avstånd d korsas av ljus. Så för att beräkna det baserat på dessa parametrar kan följande formel fastställas:
A = ε⋅C⋅d
I ovanstående formel, ε är en konstant av proportionalitet som kallas molär absorptionsförmåga.
Molar absorptionsförmåga beror på typen av substans och våglängden vid vilken absorbansen mäts. De molär absorptionsförmåga den är också känslig för provtemperatur och provets pH.
Beer-Lambert Law
Detta förhållande mellan absorbans, absorptionsförmåga, koncentration och distans av tjockleken på vägen som ljuset följer i provet kallas Beer-Lambert-lagen..

Här är några exempel på hur du använder den.
Exempel
Exempel 1
Under ett experiment belyses ett prov med rött ljus från en heliumneonlaser vars våglängd är 633 nm. En elektrofotometer mäter 30 mV när laserljus träffar direkt och 10 mV när det passerar genom ett prov..
I detta fall är transmittansen:
T = I / Io = 10 mV / 30 mV = ⅓.
Och absorbansen är:
A = - log (⅓) = log (3) = 0,48
Exempel 2
Om samma ämne placeras i en behållare som är hälften så tjock som den som användes i exempel 1, ange hur mycket elektrofotometern kommer att markera när ljuset från heliumneonlasern passerar genom provet.
Det måste beaktas att om tjockleken minskar med hälften, så minskar absorbansen som är proportionell mot den optiska tjockleken med hälften, det vill säga A = 0,28. Transmittansen T kommer att ges av följande förhållande:
T = 10-A = 10 ^ (- 0,28) = 0,53
Elektrofotometern läser 0,53 * 30 mV = 15,74 mV.
Lösta övningar
Övning 1
Vi vill bestämma molabsorptionsförmågan för en viss proprietär förening som är i lösning. För att göra detta belyses lösningen med ljus från en 589 nm natriumlampa. Provet placeras i en 1,50 cm tjock provhållare.
Utgångspunkten är en lösning med en koncentration av 4,00 × 10 ^ -4 mol per liter och transmittansen mäts, vilket resulterar i 0,06. Använd dessa data för att bestämma molens absorptionsförmåga för provet..
Lösning
Först bestäms absorbansen, vilken definieras som den minsta logaritmen för att basera tio av transmittansen:
A = - logg (T)
A = - logg (0,06) = 1,22
Sedan används Lambert-Beer-lagen som etablerar ett samband mellan absorbans, molarabsorptionsförmåga, koncentration och optisk längd:
A = ε⋅C⋅d
För att lösa molär absorptionsförmåga erhålls följande förhållande:
e = A / (Cdd)
ersätta de givna värdena vi har:
ε = 1,22 / (4,00 × 10 ^ -4 M1,5 cm) = 2030 (M ^ cm) ^ - 1
Ovanstående resultat har avrundats till tre signifikanta siffror.
Övning 2
För att förbättra precisionen och bestämma felet vid mätningen av molens absorptionsförmåga hos provet i övning 1 späds provet successivt ut till halva koncentrationen och transmittansen mäts i varje fall..
Med utgångspunkt från Co = 4 × 10 ^ -4 M med transmittans T = 0,06 erhålls följande sekvens av data för transmittans och absorbans beräknad från transmittans:
Co / 1-> 0,06-> 1,22
Co / 2-> 0,25-> 0,60
Co / 4-> 0,50-> 0,30
Co / 8-> 0,71-> 0,15
Co / 16-> 0,83-> 0,08
Co / 32-> 0,93-> 0,03
Co / 64-> 0,95-> 0,02
Co / 128-> 0,98-> 0,01
Co / 256-> 0,99-> 0,00
Med dessa data utföra:
a) Ett diagram över absorbans kontra koncentration.
b) En linjär passning av data och hitta lutningen.
c) Beräkna molär absorptionsförmåga från den erhållna lutningen.
Lösning
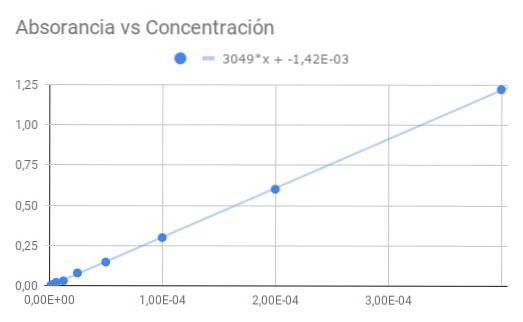
Lutningen som erhålls är produkten av den molära absorptionsförmågan och det optiska avståndet, så genom att dividera lutningen med längden 1,5 cm får vi den molära absorptionsförmågan
ε = 3049 / 1,50 = 2033 (M⋅cm) ^ - 1
Övning 3
Med uppgifterna från övning 2:
a) Beräkna absorptionsförmågan för varje data.
b) Bestäm ett medelvärde för molarabsorptionsförmågan, dess standardavvikelse och det statistiska felet som är associerat med genomsnittet..
Lösning
Den molära absorptionsförmågan beräknas för var och en av de testade koncentrationerna. Kom ihåg att ljusförhållandena och det optiska avståndet förblir fasta.
Resultaten för molär absorptionsförmåga är:
2033, 2007, 2007, 1983, 2158, 1681, 2376, 1872, 1862 i enheter om 1 / (M * cm).
Från dessa resultat kan vi ta det genomsnittliga värdet:
<ε> = 1998 (M * cm) ^ - 1
Med en standardavvikelse på: 184 (M * cm) ^ - 1
Medelfelet är standardavvikelsen dividerad med kvadratroten av antalet data, det vill säga:
Δ<ε>= 184/9 ^ 0,5 = 60 (M * cm) ^ - 1
Slutligen dras slutsatsen att det patenterade ämnet har en molarabsorptionsförmåga vid frekvensen 589 nm producerad av en natriumlampa av:
<ε> = (2000 ± 60) (M * cm) ^ - 1
Referenser
- Atkins, P. 1999. Fysisk kemi. Omega-utgåvor. 460-462.
- Guiden. Transmittans och absorbans. Återställd från: quimica.laguia2000.com
- Miljötoxikologi. Transmittans, absorbans och Lamberts lag. Återställd från: repositorio.innovacionumh.es
- Fysiskt äventyr. Absorbans och transmittans. Återställd från: rpfisica.blogspot.com
- Spektofotometri. Återställd från: chem.libretexts.org
- Miljötoxikologi. Transmittans, absorbans och Lamberts lag. Återställd från: repositorio.innovacionumh.es
- Wikipedia. Absorbans Återställd från: wikipedia.com
- Wikipedia. Spektrofotometri. Återställd från: wikipedia.com



Ingen har kommenterat den här artikeln än.