
Acetanilid (C8H9NO) struktur, egenskaper, syntes
De acetanilid (C8H9NO) är en aromatisk amid som får flera ytterligare namn: N-acetylarylamin, N-fenylacetamid och acetanil. Det presenteras som ett luktfritt fast ämne i form av flingor, dess kemiska natur är amid och som sådan kan det bilda brandfarliga gaser när det reagerar med starka reduktionsmedel..
Dessutom är det en svag bas som kan reagera med uttorkande medel såsom PtvåELLER5 för att ge upphov till en nitril. Acetanilid befanns ha smärtstillande och febernedsättande verkan och användes 1886 under namnet Antifebrina av A. Cahn och P. Hepp..

1899 introducerades acetylsalicylsyra (aspirin) på marknaden, som hade samma terapeutiska verkningar som acetanilid. Eftersom användningen av acetanilid var relaterad till uppkomsten av cyanos hos patienter - en följd av acetanilidinducerad metemoglobinemi - utesluts dess användning..
Därefter fastställdes att den analgetiska och febernedsättande verkan av acetanilid låg i en metabolit av den som kallas paracetamol (acetoaminophen), som inte hade sina toxiska effekter, som föreslagits av Axelrod och Brodie..
Artikelindex
- 1 Kemisk struktur
- 1.1 Resonansstrukturer och intermolekylära interaktioner
- 2 Kemiska egenskaper
- 2.1 Molekylvikt
- 2.2 Kemisk beskrivning
- 2.3 Lukt
- 2.4 Smak
- 2.5 Kokpunkt
- 2.6 Smältpunkt
- 2.7 Flampunkt eller flampunkt
- 2.8 Densitet
- 2.9 Ångdensitet
- 2.10 Ångtryck
- 2.11 Stabilitet
- 2.12 Volatilitet
- 2.13 Självantändning
- 2.14 Sönderfall
- 2,15 pH
- 2.16 Löslighet
- 3 Syntes
- 4 applikationer
- 5 Referenser
Kemisk struktur
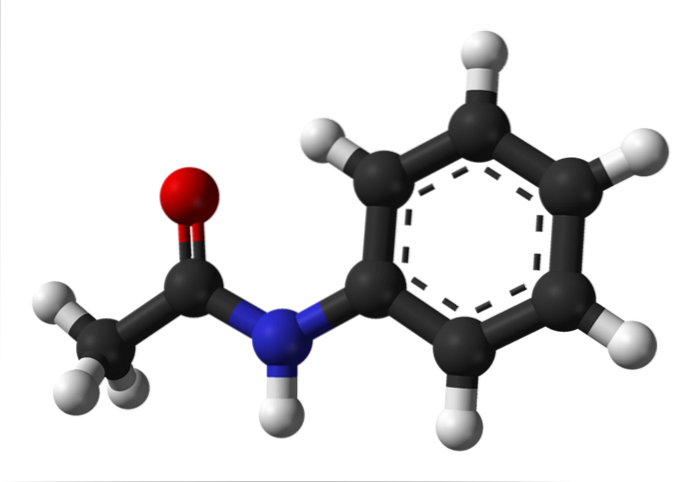
Den övre bilden representerar acetanilids kemiska struktur. Till höger är den sexkantiga aromatiska ringen av bensen (med prickade linjer) och till vänster är anledningen till att föreningen består av en aromatisk amid: acetamidogruppen (HNCOCH3).
Acetamidogruppen ger bensenringen en större polär karaktär; det vill säga det skapar ett dipolmoment i acetanilidmolekylen.
Varför? Eftersom kväve är mer elektronegativt än någon av kolatomerna i ringen och också är bunden till acylgruppen, vars O-atom också lockar elektrontäthet.
Å andra sidan vilar nästan hela molekylstrukturen av acetanilid på samma plan på grund av sp-hybridiseringtvå av atomerna som komponerar den.
Det finns ett undantag kopplat till de i -CH-gruppen3, vars väteatomer utgör topparna på en tetraeder (de vita sfärerna längst till vänster kommer ut ur planet).
Resonansstrukturer och intermolekylära interaktioner
Det ensamma paret utan delning i N-atomen cirkulerar genom π-systemet i den aromatiska ringen, med ursprung i flera resonansstrukturer. En av dessa strukturer hamnar dock med en negativ laddning på O-atomen (mer elektronegativ) och en positiv laddning på N-atomen..
Således finns det resonansstrukturer där en negativ laddning rör sig i ringen, och en annan där den finns i O-atomen. Som en konsekvens av denna "elektroniska asymmetri" - som kommer hand i hand med molekylär asymmetri - interagerar acetanilid intermolekylärt med dipol -dipoliska krafter.
Emellertid är vätebindningsinteraktioner (N-H-O- ...) mellan två acetanilidmolekyler i själva verket den dominerande kraften i deras kristallstruktur..
Således består acetanilidkristaller av ortorhombiska enhetsceller med åtta molekyler orienterade i "platt band" -form med sina vätebindningar..
Detta kan visualiseras genom att placera en acetanilidmolekyl ovanpå den andra, parallellt. Så som HNCOCH-grupperna3 överlappar rumsligt bildar de vätebindningar.
Dessutom kan en tredjedel också "glida" mellan dessa två molekyler, men med sin aromatiska ring som pekar mot motsatt sida..
Kemiska egenskaper
Molekylvikt
135,166 g / mol.
Kemisk beskrivning
Fast vitt eller benvitt. Bildar blanka vita flingor eller ett vitt kristallint pulver.
Odör
Toalett.
Smak
Något kryddig.
Kokpunkt
304 ° C till 760 mmHg (579 ° F till 760 mmHg).
Smältpunkt
114,3 ° C (237,7 ° F).
Flampunkt eller flampunkt
169 ° C (337 ° F). Mätning i öppet glas.
Densitet
1 219 mg / ml vid 15 ° C (1 219 mg / ml vid 59 ° F)
Ång-densitet
4,65 i förhållande till luft.
Ångtryck
1 mmHg vid 237ºF, 1,22 × 10-3 mmHg vid 25 ° C, 2Pa vid 20 ° C.
Stabilitet
Det genomgår en kemisk omläggning när den utsätts för UV-ljus. Hur förändras strukturen? Acetylgruppen bildar nya bindningar på ringen vid orto- och parapositionerna. Dessutom är den stabil i luft och oförenlig med starka oxidationsmedel, frätande ämnen och alkalier..
flyktighet
Märkbart flyktigt vid 95 ºC.
Självantändning
1004ºF.
Sönderfall
Den sönderdelas vid uppvärmning och avger en mycket giftig rök.
pH
5-7 (10 g / 1 av HtvåEller vid 25 ºC)
Löslighet
- I vatten: 6,93 × 103 mg / ml vid 25 ºC.
- Löslighet av 1 g acetanilid i olika vätskor: i 3,4 ml alkohol, 20 ml kokande vatten, 3 ml metanol, 4 ml aceton, 0,6 ml kokande alkohol, 3,7 ml kloroform, 5 ml gliecerol, 8 ml av dioxan, 47 ml bensen och 18 ml eter. Klorhydrat ökar lösligheten av acetanilid i vatten.
Syntes
Det syntetiseras genom att reagera ättiksyraanhydrid med acetanilid. Denna reaktion förekommer i många texter inom organisk kemi (Vogel, 1959):
C6H5NHtvå + (CH3CO)tvåO => C6H5NHCOCH3 + CH3COOH
Applikationer
-Det är ett hämmande medel för nedbrytningsprocessen av väteperoxid (väteperoxid).
-Stabiliserar cellulosaesterlack.
-Det ingriper som mellanhand för att påskynda gummiproduktionen. På samma sätt är det en mellanhand i syntesen av vissa färgämnen och kamfer..
-Fungerar som en föregångare vid syntesen av penicillin.
-Det används vid framställning av 4-acetamidosulfonylbensenklorid. Acetanilid reagerar med klorsulfonsyra (HSO3Cl), vilket alstrar 4-aminosulfonylbensenklorid. Detta reagerar med ammoniak eller en primär organisk amin för att bilda sulfonamider..
-Det användes experimentellt på 1800-talet i utvecklingen av fotografering.
-Acetanilid används som en markör för elektroosmotiska flöden (EOF) i kapillärelektrofores för studier av sambandet mellan läkemedel och proteiner..
-Nyligen (2016) har acetanilid kopplats till 1- (ω-fenoxialkyluracil) i experiment för att hämma replikering av hepatit C. Acetanilid binder till position 3 i pyrimidinringen.
-De experimentella resultaten indikerar en minskning av replikationen av virusgenomet, oavsett viral genotyp..
-Innan toxiciteten för acetanilid identifierades användes den som ett smärtstillande medel och febernedsättande från 1886. Senare (1891) användes den vid behandling av kronisk och akut bronkit av Grün.
Referenser
- J. Brown & D. E. C. Corbridge. (1948). Kristallstruktur av acetanilid: användning av polariserad infraröd strålning. Naturvolym 162, sida 72. doi: 10.1038 / 162072a0.
- Grün, E. F. (1891) Användningen av acetanilid vid behandling av akut och kronisk bronkit. Lancet 137 (3539): 1424-1426.
- Magri, A. et al. (2016). Utforskning av acetanilidderivat av 1- (ω-fenoxialkyl) uraciler som nya hämmare av hepatit C-virusreplikation. Sci. Rep. 6, 29487; doi: 10.1038 / srep29487.
- Merck KGaA. (2018). Acetanilid. Hämtad den 5 juni 2018 från: sigmaaldrich.com
- SIDS inledande bedömningsrapport för 13: e SIAM. Acetanilid. [PDF]. Hämtad den 5 juni 2018 från: inchem.org
- Wikipedia. (2018). Acetanilid. Hämtad den 5 juni 2018 från: en.wikipedia.org
- PubChem. (2018). Acetanilid. Hämtad den 5 juni 2018 från: pubchem.ncbi.nlm.nih.gov


Ingen har kommenterat den här artikeln än.