
LIA Agar (lysinjärn) bakgrund, beredning och användning
De LIA-agar (Iron Lysine) är ett biokemiskt test som används för att identifiera bakterier i Enterobacteriaceae-familjen. Detta medium skapades av Edwards och Fife, baserat på Falkow-formeln.
Ursprungligen var detta test en buljong som innehöll peptoner, jästextrakt, glukos, L-lysin, bromokresollila och destillerat vatten. Edwards och Fife tillsatte agar-agar, järnammoniumcitrat och natriumtiosulfat..
Testet består i grunden av att visa närvaron av enzymet lysindekarboxylas, som kan reagera med karboxylgruppen i aminosyran L-lysin. En deaminering av aminosyran kan också uppstå på grund av närvaron av enzymet lysindeaminas..
Dessutom möjliggör sammansättningen av mediet bevis på förmågan hos vissa bakterieslag att producera vätesulfid. Slutligen är det också möjligt att observera alstring eller inte av gas i mediet.
Artikelindex
- 1 Motivering
- 1.1 Peptoner och jästextrakt
- 1.2 Glukos
- 1.3 L-lysin
- 1,4 pH-indikator (bromokresollila)
- 1,5 Ferriammoniumcitrat och natriumtiosulfat
- 2 Tolkning av testet
- 2.1 Dekarboxylering av lysin
- 2.2 Deaminering av lysin
- 2.3 Produktion av vätesulfid (H2S)
- 3 Resultatregistrering
- 4 Förberedelse
- 5 användningsområden
- 6 Referenser
Grund
Peptoner och jästextrakt
Liksom de flesta odlingsmedier innehåller lysinjärnagar komponenter som ger källan till näringsämnen som behövs för bakterietillväxt. Dessa komponenter representeras av peptoner och jästextrakt.
Glukos
På samma sätt innehåller denna agar glukos som ett jäsbart kolhydrat. Alla bakterier i Enterobacteriaceae-familjen är kända för att jäsa glukos.
Detta steg är avgörande, eftersom det kommer att vara ansvarigt för försurning av mediet, ett väsentligt tillstånd för enzymet lysindekarboxylas - om det finns närvarande - att verka på dess substrat..
I vissa bakterieslag kan gasproduktion observeras på grund av glukosfermentering.
Gasen påvisas när det finns en förskjutning av agaren i röret, vilket lämnar ett tomt utrymme längst ner på röret, eller genom sprickbildning av mediet i två eller flera delar.
L-lysin
När lysin är decarboxylerat bildas en diamin (kadaverin) och koldioxid.
Dekarboxylering sker i närvaro av pyridoxalfosfatkoenzym. Denna reaktion är irreversibel.
PH-indikator (bromokresollila)
Alla pH-förändringar som sker i mediet på grund av de olika reaktionerna detekteras av den purpurfärgade bromkresol-pH-indikatorn..
I denna mening, när det finns försurning blir mediet gult, och när det finns alkalisering återgår mediet till sin ursprungliga lila eller lila färg..
När deaminering av lysin sker på grund av närvaron av enzymet lysindeaminas bildas en rödaktig färg på ytan, typiskt i släktena Proteus, Providencia och vissa arter av Morganella.
Detta beror på det faktum att alfa-keto-kolsyra bildas under deamineringsprocessen, som reagerar med ammoniumcitrat i närvaro av syre och orsakar ovan nämnda färg..
Ferriammoniumcitrat och natriumtiosulfat
Å andra sidan kommer bakterier som producerar vätesulfid att bevisas av närvaron av natriumtiosulfat (svavelkälla) och ferriammoniumcitrat, som är utvecklaren av HtvåS.
Bakterier som har enzymet tiosulfatreduktas har förmågan att verka genom att reducera natriumtiosulfat närvarande och bilda sulfit och vätesulfid (HtvåS).
Den senare är en färglös gas, men när den reagerar med järnsaltet bildar den järnmetallisk sulfid, som är en olöslig förening (synlig svart fällning).
Bildningskapaciteten för HtvåS med detta medium är inte särskilt tillförlitligt, eftersom vissa lysindekarboxylasnegativa bakterier kan producera HtvåS kommer inte att bilda den svarta fällningen, eftersom mediet surhet stör. Det rekommenderas därför att kontrollera med andra medier som innehåller järn.
Tolkning av testet
Lysindekarboxylering
Rören bör läsas efter 24 timmars inkubation, annars finns det en risk för felaktig tolkning av reaktionen och rapporterar falska negativ..
Man måste komma ihåg att den första reaktionen som kommer att inträffa är jäsning av glukos, därför blir alla rör efter 10 till 12 timmar gula..
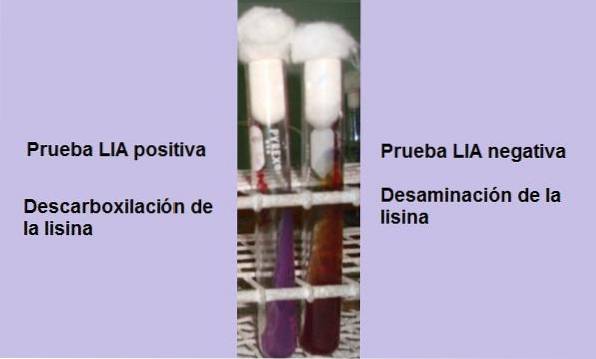
Om vid slutet av inkubationstiden (24 timmar) observeras en gul bakgrund med en lila eller lila yta är reaktionen negativ. Ytans lila färg motsvarar alkaliseringen av mediet genom användning av peptoner.
En positiv reaktion är en där botten och ytan på röret är helt lila, det vill säga det återgår till den ursprungliga färgen..
Därför är vem som bestämmer testets positivitet basen eller bakgrunden för mediet. Om du är osäker på färgen kan den jämföras med ett icke-inokulerat LIA-rör.
Deaminering av lysin
Ett rör som visar lysindeaminering kommer att ha en rödaktig rödbrun yta och en gul (syra) bakgrund, eller så kommer hela röret att ha en rödaktig rödbrun färg..
Denna reaktion tolkas som negativ för lysindekarboxylering, men positiv för lysindeaminering..
Denna reaktion definieras och tolkas på ramen.
Produktion av vätesulfid (HtvåS)
En positiv reaktion observeras genom att en svart fällning uppträder i hela eller delar av mediet. Vanligtvis mellan kanten på fasningen och basen.
Om fällningen sker i hela röret visar den inte de andra reaktionerna som uppträder i mitten..
Registrera resultat
Vid tolkningen av testet registreras resultaten enligt följande:
Ramen läses först, sedan botten eller blocket, sedan produktionen av HtvåJa, och slutligen gasproduktion.
Exempel: K / A + (-). Detta betyder:
- K: Alkalisk ram (lila färg)
- A: Sur bakgrund (gul), dvs negativ dekarboxyleringsreaktion och negativ deaminering.
- +: Produktion av vätesulfid
- (-): Utan gas.
Förberedelse
Väg 35 g av det torkade järnagarlysinmediet och lös upp i en liter destillerat vatten..
Värm upp tills agaren löser sig helt, låt den koka i en minut och rör om ofta. Fördela 4 ml av mediet i 13/100 provrör med bomullslock.
Sterilisera i en autoklav vid 121 ° C i 15 minuter. Ta bort från autoklaven och låt stå i en vinkel så att det finns en djup bas och en kort fas.
Förvara i kylskåp 2-8 ° C. Låt det värmas innan bakteriestammen sås.
Det uttorkade mediet är beige och det beredda mediet är rödlila..
Det slutliga pH-värdet för det beredda mediet är 6,7 ± 0,2
Mediet blir gult med pH lika med eller mindre än 5,2 och är lila vid pH 6,5 och högre.
Applikationer
Detta test, tillsammans med andra biokemiska tester, används för att identifiera basiller av Enterobacteriaceae-familjen..
Mediet sås ut med en rak slinga eller nål, en eller två punkteringar görs till rörets botten och sedan görs ytan på mediet i en sicksack..
Inkubera i 24 timmar vid 35-37 ° C i aerobios. Inkubera vid behov ytterligare 24 timmar..
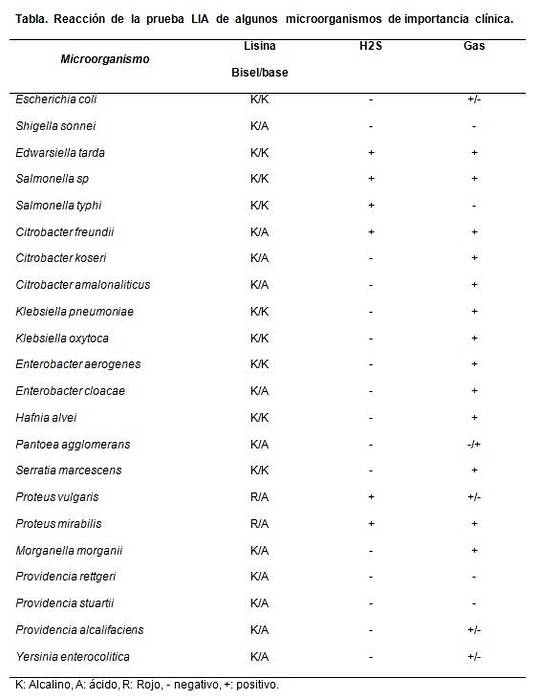
Det är främst användbart att skilja laktosnegativa Citrobacter-arter från Salmonellas sp.
Referenser
- Mac Faddin J. (2003). Biokemiska tester för identifiering av bakterier av klinisk betydelse. 3: e upplagan Ledare Panamericana. Buenos Aires. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott mikrobiologisk diagnos. 12 utgåva Redaktionellt Panamericana S.A. Argentina.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnos. 5: e upplagan Redaktionellt Panamericana S.A. Argentina.
- Britannia Laboratories. Lysinjärnagar. 2015.Tillgängligt på: britanialab.com
- BD Laboratories. BBL Lysine Iron Agar Slants. 2007. Tillgänglig på: bd.com
- Valtek Laboratories. Mellersta L.I.A. 2009. Tillgänglig på: andinamedica.com



Ingen har kommenterat den här artikeln än.